Historia
Los comienzos de la virología vegetal se remontan a finales del siglo XIX, cuando el microbiólogo holandés Martinus Beijerinck y el científico ruso Dmitrii Iwanowski investigaban la causa de una misteriosa enfermedad del tabaco (Scholthof 2001). Estos investigadores, en forma independiente, describieron un agente inusual que causaba la enfermedad del mosaico en tabaco (Zaitlin, 1998). Lo que distinguía a este agente de otros agentes causales de enfermedades era su tamaño mucho menor al de otros microorganismos. Este agente, posteriormente denominado “virus del mosaico del tabaco” (Tobacco mosaic virus, TMV), fue el primer virus en ser descrito. Desde entonces, un gran número de diversos virus han sido encontrados en plantas, animales, hongos y bacterias. El número actual de virus reconocidos es cerca de 4,000, de los cuales cerca de 1,000 son virus vegetales. La principal razón por la cual estudiamos los virus vegetales es el impacto negativo que las enfermedades virales tienen en la producción de los cultivos. Históricamente, los virus han sido percibidos como una amenaza casi exclusiva a la sanidad humana, animal y vegetal. Sin embargo, los recientes progresos como resultado de un mayor entendimiento de las interacciones virus-hospedante han transformado a los virus en importantes herramientas biomédicas y biotecnológicas. Por ejemplo, los virus vegetales se usan para producir en las plantas grandes cantidades de proteínas de interés (Pogue et al. 2002) y para desarrollar vacunas seguras y de bajo costo contra virus humanos y animales (Walmsley and Arntzen 2000).
Biología Básica
Los virus representan no sólo otro grupo de patógenos, sino una forma de vida fundamentalmente diferente. A diferencia de otros organismos vivos, los virus son no-celulares. En contraste a las células, que se multiplican dividiéndose en células hijas, los virus se organizan a partir de sus propios componentes estructurales. Las partículas virales maduras están inactivas; se activan y replican sólo dentro de las células infectadas. En otras palabras, los virus son parásitos obligados que no pueden ser mantenidos en los medios de cultivos apropiados para células bacterianas, fúngicas, vegetales o animales. Todos los virus están desprovistos de las maquinarias celulares para sintetizar proteínas y producir energía. Como regla general, las partículas virales son inmóviles fuera del hospedante infectado; necesitan de la ayuda de otros organismos o del ambiente para su diseminación.
Morfología
Hay un simple principio estructural que se puede aplicar virtualmente a cualquier virus en su forma madura. Las partículas virales (viriones) están compuestas por dos partes principales: el genoma compuesto de ácido nucleico, y una cubierta proteica, la cual proteje la particula viral. Además, algunas partículas virales están recubiertas por una membrana externa compuesta de lípidos y proteínas (o membrana lipoproteica). Las cubiertas proteicas (o cápsides) de los virus vegetales se ensamblan siguiendo uno de dos tipos fundamentales de simetría. El primer tipo de virión es helicoidal (casi elongado). Hay dos variantes principales de virus elongados: los “bastones” (o barra o vara) rígidos (Figura 1) y los filamentos flexuosos (Figura 2). En ambas variantes, el ácido nucleico está altamente organizado: toma la misma conformación helicoidal que la cápside proteica. El segundo tipo de partícula viral es icosaédrica (casi esférica, Figura 3); las variantes de esta forma básica incluyen a los viriones baciliformes (Figura 4) y los viriones gemelos compuestos por la unión de dos icosaedros incompletos (Figura 5). En los viriones icosaédricos, el ácido nucleico genómico forma una esfera parcialmente organizada dentro de la cápside proteica. Tanto los viriones icosaédricos como los elongados pueden auto-ensamblarse en un tubo de ensayo si el ácido nucleico y las subunidades proteicas se incuban bajo condiciones.
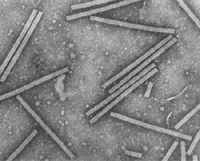
Figura 1 |

Figura 2 |

Figura 3 |

Figura 4 |

Figura 5 |
Los virus son los organismos conocidos más pequeños. El diámetro típico de un virus vegetal esférico es aproximadamente 30 nm. La partículas rígidas, en forma de bastón, del TMV miden 300 x 18 nm y consisten de un genoma de ARN de alrededor de 6,400 nucleótidos encapsulados por 2,130 copias de la cubierta proteica del TMV. Algunos de los virus filamentosos alcanzan una longitud cercana a los 2000 nm o 2 µm. A modo de comparación, el tamaño típico de una célula de mesófilo foliar mide alrededor de 50 µm.
Replicación
Como en cualquier otro organismo, la información para la replicación de los virus está contenida dentro de sus genomas (Figura 6).

Figura 6 |
Aunque el material genético de la mayoría de los organismos consiste en ADN de cadena doble (ADNcd), solo una minoría de los virus vegetales posee genomas de ADNcd. Los genomas de otros virus vegetales están compuestos de ADN de cadena simple (ADNcs). Sin embargo, la mayoría de los virus vegetales no utilizan ADN en ningún momento. En cambio, los genomas de casi todos los virus vegetales están constituidos de ARN. La mayoría de estos genomas están compuestos de ARN de cadena simple (ARNcs) que tienen la misma polaridad (sentido positivo) que las moléculas de ARN mensajero de la célula. Algunos virus de ARN utilizan ARNcs de polaridad negativa, y algunos otros tienen genomas compuestos de ADNcd. Debido a la enorme variabilidad en la naturaleza del material genético de los virus, los ciclos replicativos de diferentes virus son frecuentemente muy distintos entre sí.
Dado que los virus vegetales son parásitos biotróficos obligados, sus ciclos de vida comienzan con la penetración del virión a la célula. Los virus vegetales no pueden penetrar por sí solos la cutícula y la pared celular de las plantas. Se cree que el virión ingresa al citoplasma de la célula en forma pasiva, a través de heridas causadas por daño mecánico en la cutícula y pared celular. El paso siguiente en la infección viral es la remoción parcial o total de la cubierta proteica del virión en el citoplasma. Luego, la célula interviene en la expresión del genoma viral proveyendo un aparato de transcripción (para los virus de ADN) y un aparato de traducción (para todos los virus). Los virus de ADN deben ser transportados al núcleo para la transcripción y de esta manera tener acceso a las proteínas celulares necesarias para la producción de ARN mensajero a partir de ADN viral. La traducción de ARN viral en el citoplasma produce proteínas virales que son necesarias para completar el ciclo de vida del virus.
Todos los virus deben formar al menos tres tipos de proteínas: proteínas de replicación esenciales para la producción de ácidos nucleicos, proteínas estructurales que conforman la cubierta proteica y otros componentes de los viriones, y proteínas de movimiento que sirven de intermediarias en el transporte de los virus entre las células vegetales (Figura 6). Las proteínas de replicación viral se combinan con las proteínas celulares para producir un complejo de proteínas que fabrican múltiples copias del genoma viral. Estos nuevos genomas interactúan con las proteínas estructurales para formar nuevos viriones. El siguiente diagrama (Figura 7) ilustra los pasos que se dan dentro de la célula durante la replicación del virus del mosaico del tabaco (TMV).

Figura 7 |
El paso siguiente en el ciclo de reproducción viral es el movimiento del virus a las células vecinas. Dependiendo del tipo de virus, el transporte de los genomas virales o los viriones a las células vecinas se produce a través de pequeños canales, llamados plasmodesmos, que forman conexiones entre las células. Muchos virus producen proteínas de movimiento que modifican los canales plasmodesmáticos y posibilitan el movimiento viral hacia las células circundantes. El siguiente diagrama (Figura 8) ilustra el movimiento de TMV desde una célula infectada hacia una célula vecina.

Figura 8 |
El proceso de movimiento de célula a célula es relativamente lento: el tiempo de multiplicación viral en una célula y su posterior movimiento a otra varía entre una y varias horas. Para poder colonizar exitosamente toda la planta, el virus necesita ingresar al sistema vascular. El proceso de transporte sistémico o de larga distancia normalmente se da a través de los tubos cribosos del floema, donde los virus se mueven pasivamente con el flujo de fotosintatos. Luego de una dispersión viral sistémica relativamente rápida (centímetros por hora) en el floema, el virus pasa del floema a las células circundantes, donde se reproduce y disemina moviéndose de célula a célula. El tiempo entre la infección inicial de una o pocas células y la infección sistémica del hospedante varía entre unos pocos días a pocas semanas, dependiendo del virus, el hospedante y las condiciones ambientales. La transmisión de un virus de una planta a otra (ver sección supervivencia y diseminación) completan el ciclo de vida del virus.
Sistemática
Idealmente, la sistemática (el estudio de las distintas clases de organismos y las relaciones entre ellos) debería reflejar la historia evolutiva de las especies biológicas. Dicha historia puede construirse a través del análisis de antecesores fósiles y por la comparación de los genes de organismos existentes (análisis filogenéticos). Debido a que no hay registros fósiles virales, su evolución puede reconstruirse con cierta certeza solo a través de análisis filogenéticos. Este tipo de análisis tiene una resolución relativamente buena a niveles taxonómicos intermedios, tales como género y familia del virus. Sin embargo, debido a la propia naturaleza de las formas de vida virales, se vuelve más complicado o aún poco factible a niveles inferiores (especie) o superiores. Debido a que los virus presentan altas tasas de replicación y mutación, cada ciclo replicativo produce un número de variantes genéticamente similares pero no idénticas. La posterior selección y evolución de estos genomas levemente diferentes da como resultado un continuo de variantes que van desde mutaciones puntuales hasta cepas virales. A diferencia de los organismos celulares, los cuales parecen haberse originado a partir de un ancestro común, es muy factible que los virus hayan tenido orígenes múltiples. La diversidad de orígenes de los distintos grupos de virus permite que su clasificación evolutiva pueda hacerse solo dentro de ciertos tipos de virus, tales como los virus que tienen genomas de ARN de sentido positivo, o los virus de genomas pequeños de ADNcs.
Al considerar la clasificación de los virus vegetales, no debemos olvidar que el primer virus vegetal fue purificado y caracterizado a mediados de 1930. Anteriormente, la mayoría de los virólogos vegetales daban nombre a los virus en base al hospedante en el cual el virus había sido encontrado y de acuerdo al tipo de síntoma que ese virus causaba en dicho hospedante. Por ejemplo, el virus del tabaco del mosaico fue descrito por primera vez en plantas de tabaco, en las cuales inducía un mosaico en las hojas (Figura 9). Los nombres de los virus son usualmente expresados como acrónimos (nota del traductor: derivados de sus siglas en inglés); por ejemplo el “virus del tabaco del mosaico” es abreviado TMV (del inglés
Tobacco mosaic virus), y el “virus del marchitamiento moteado del tomate” es abreviado TSWV (del inglés
Tomato spotted wilt virus). Los nombres de muchos géneros y familias de virus derivan de algún virus importante dentro de la familia. Por ejemplo, el nombre de la familia
Bromoviridae deriva del
Brome mosaic virus, el cual está en dicha familia.

Figura 9 |
Las mayores subdivisiones de virus vegetales están definidas por la constitución química de sus genomas (Plant Viruses Online
http://image.fs.uidaho.edu/vide/refs.htm ). En general, la mayor parte de los virus vegetales poseen genomas de ARN de cadena simple de sentido positivo, y estos virus reciben entonces el nombre de virus de ARN de cadena positiva. Dentro de esta categoría, existen numerosos ejemplos de familias de virus de importancia económica, tales como
Bromoviridae, Closteroviridae, Luteoviridae, y Potyviridae. Relativamente pocos virus vegetales, tales como las familias
Bunyaviridae y
Rhabdoviridae poseen genomas de ARN de sentido negativo.
Reoviridae es la familia más grande de virus de ARN de doble cadena. Solamente los virus de la familia
Caulimoviridae (también conocidos como para-retrovirus), poseen genomas de ADN de doble cadena y para su replicación es necesaria la presencia de un ARN intermediario. Los verdaderos virus vegetales de ADN están dentro de la familia
Geminiviridae, la cual es muy amplia y tiene gran importancia económica. Estos virus poseen genomas de ADNcs, y tienen un ADNcd intermediario en sus ciclos de vida (Hull 2002). Las relaciones evolutivas entre de los virus de cadena positiva, los de cadena negativa y los virus de ARNcd, así como en los para-retrovirus y los virus de ADNcs son extremadamente distantes y probablemente inexistentes.
Supervivencia y diseminación
La supervivencia a largo plazo (incluso por décadas) de relativamente pocos virus, tales como TMV, se da en el ambiente o por la transmisión mecánica pasiva de una planta a otra (Ford and Evans, 2003). La mayoría de los virus vegetales son transmitidos en forma activa de una planta infectada a otra sana por un organismo vivo, llamado vector. Los artrópodos herbívoros, nematodos, y hongos fitófagos son los principales tipos de vectores de virus vegetales (Walkey, 1991). Entre ellos, los áfidos y las moscas blancas (Figuras 10A, B, C) tienen la capacidad de transmitir el mayor número de especies de virus. La mayoría de los virus se transmiten activamente por vectores a plantas sanas en cuestión de segundos, horas o días. Además, algunos virus se transmiten a partir plantas infectadas cuando éstas son propagadas vegetativamente, por ejemplo, como tubérculos o injertos. También, puede haber transmisión “vertical” a partir de semillas o polen de plantas infectadas. Este tipo de transmisión es particularmente importante para la supervivencia invernal de los virus.

Figura 10 |
La transmisión de los virus a través de un vector es un proceso sumamente específico. Cada virus puede transmitirse solamente por un tipo de vector (por ejemplo, áfido) y no por otro (por ejemplo, mosca blanca). Contrariamente, cada especie de vector (por ejemplo el áfido verde del durazno
Myzus persicae) puede transmitir algunos virus (por ejemplo, el virus amarillo de la remolacha, o
Beet yellow virus) pero no otros (por ejemplo, el virus de la tristeza de los cítricos, o
Citrus tristeza virus), a pesar de que estos virus son genéticamente muy similares entre sí.
La interacción entre un virus y su vector especifico, y que da como resultado la transmisión viral, varía entre diferentes vectores. Las relaciones que se dan entre los virus y sus vectores son complejas y de gran interés para los virólogos vegetales ya que los vectores proveen el principal modo de dispersión de muchos de los virus que causan importantes pérdidas económicas. Para algunas combinaciones de virus-vector, la interacción entre el virus y su vector es muy superficial y es el resultado de la fijación del virus a las superficies externas de las partes bucales del vector. Por ejemplo, los virus del genero
Potyvirus producen una proteína especial llamada componente ayudante (“helper component”) que actúa como adhesivo entre los viriones y los estiletes de los áfidos. En este caso, la adquisición del virus a partir de plantas infectadas y la inoculación del virus en plantas sanas toma de segundos a minutos (Pirone and Blanc, 1996). Contrariamente, los virus de la familia
Luteoviridae circulan en sus vectores (áfidos) moviéndose a través de la pared intestinal (o: hemocel) hacia la cavidad corporal, y recién así pasa a la saliva del áfido (Figura 11).


Figura 11 |
A estos virus, les toma cerca de 12 horas circular dentro de su vector (áfido) antes de poder ser transmitidos a otra planta (Gray and Gildow, 2003). Para otros vectores de virus vegetales, la relación es muy “íntima” y los virus en realidad se multiplican dentro de las células de sus insectos vectores. Por ejemplo, el virus del marchitamiento moteado del tomate (Tomato spotted wilt virus) se multiplica en las células de su vector (thrips), y una vez que los thrips adquieren el virus lo pueden transmitir mientras vivan (Sherwood et al. 2003). A estos virus vegetales que se multiplican en sus insectos vectores se los consideran virus de plantas y de insectos simultáneamente. Debido a que las prácticas de manejo de enfermedades con frecuencia están diseñadas para controlar a los vectores, entender el proceso de transmisión viral es de suma importancia para el desarrollo de estrategias efectivas de manejo de enfermedades causadas por virus vegetales.
Interacciones Planta-Virus
En teoría, los virus pueden infectar todas las especies de plantas cultivadas y silvestres. Sin embargo, los rangos de hospedantes de cada virus son variables, pudiendo ser muy reducidos o muy amplios. Por ejemplo, el virus de la tristeza de los cítricos (Citrus tristeza virus) infecta solamente a pocas especies del género
Citrus, mientras que el virus del mosaico del pepino (Cucumber mosaic virus) afecta a más de 1000 especies en 85 familias de plantas. La susceptibilidad o resistencia de las especies y cultivares vegetales a los virus está determinada principalmente por el genotipo del hospedante. Las plantas poseen mecanismos activos y pasivos para prevenir la infección viral. Las defensas pasivas se dan cuando la planta no produce uno o más de los factores requeridos para la reproducción del virus y su dispersión en el hospedante. Las defensas activas incluyen la detección y destrucción de células infectadas con el virus, y son producidas por genes de resistencia específicos en la planta. Normalmente, los genes de resistencia son efectivos solamente contra un virus en particular. Además, las plantas poseen un sistema general de defensa comparable con el sistema inmune animal. La principal diferencia entre ambos es que el sistema inmune animal actúa sobre las proteínas del patógeno, mientras que el sistema de defensa vegetal, conocido como silenciamiento por ARN (“RNA silencing”), detecta y degrada las moléculas de ARN viral (Wassenegger and Pélissier 1998).
Dependiendo de la combinación especial de virus y hospedante, y de las condiciones ambientales, la respuesta vegetal a una infección puede ser desde asintomática hasta enfermedad severa y muerte de la planta. En algunos casos, en el lugar de infección se desarrollan lesiones localizadas (pequeños puntos cloróticos y necróticos) (Figura 12) En la mayoría de los casos, los virus se dispersan a través de toda la planta causando una infección sistémica.

Figura 12 |
Los síntomas foliares típicos de enfermedades virales incluyen patrones de mosaico (Figura 9), lesiones cloróticas o necróticas (Figura 13), amarillamiento, estrías o franjas (Figura 14 y 15), descoloración y formación de bandas en las nervaduras (Figura 16)y enrollamiento y curvatura foliar (Figura 17). Los síntomas florales incluyen deformación y cambio en el color de las flores, con posible mosaico, llamado “corrimiento” o “quebrado” del color (Figura 18 y 19). Los síntomas en frutos y otros órganos vegetales incluyen patrones de mosaico (Figura 20), achaparramiento, descoloración o malformación (Figura 21), y anillados cloróticos (Figura 22 y 23). Los tallos de las plantas pueden desarrollar quebraduras, hundimientos y tumores en respuesta a la infección viral (Figura 24).

Figura 13 |

Figura 14 |

Figura 15 |

Figura 16 |

Figura 17 |

Figura 18 |

Figura 19 |

Figura 20 |

Figura 21 |

Figura 22 |

Figura 23 |

Figura 24 |
Los síntomas inducidos por los virus vegetales conllevan a una reducción de la calidad y rendimiento de los cultivos. La importancia de estas pérdidas queda demostrada por los tres siguientes ejemplos. En África, el virus del hinchamiento de los brotes del cacao (Cacao swollen shoot virus) (Bowers et al. 2001) causa, aproximadamente, pérdidas anuales de 50,000 toneladas de granos de cacao lo cual representa un valor estimado de $28 millones de dólares. En el sudeste asiático, la infección del arroz con el virus del tungro del arroz (Rice tungro virus) provoca una pérdida anual estimada de $1.5 billones de dólares (Hull 2002). El virus del marchitamiento manchado del tomate (Tomato spotted wilt virus) infecta a una amplia variedad de plantas, incluyendo tomate, maní y tabaco (Sherwood et al. 2003), y las pérdidas anuales mundiales estimadas debido a la infección por este virus rondan el $1 billón de dólares (Hull 2002).
El resultado final de la infección viral es una reducción en el crecimiento vegetal, disminución del rendimiento, menor calidad y pérdidas económicas para aquellos que trabajan en la producción vegetal. La mayoría de los síntomas inducidos por los virus pueden darse también debido a condiciones ambientales adversas y a enfermedades causadas por otros agentes fitopatógenos. Por esta razón, el correcto diagnóstico de enfermedades virales normalmente requiere de pruebas específicas de laboratorio.
Diagnóstico de enfermedades causadas por virus vegetale
Debido a que diferentes virus pueden producir síntomas similares, el fenotipo de la enfermedad puede proveer solamente información limitada, aunque útil, para el diagnóstico de la enfermedad. Los métodos de identificación viral más específicos y confiables se basan en diferentes propiedades de los virus. Estas características y sus correspondientes aplicaciones incluyen:
-
Patogenicidad.Bioensayos que usan plantas indicadoras. Algunos géneros vegetales, tales como
Nicotiana (tabaco) y
Chenopodium (quinoa) son hospedantes de un gran número de virus. Debido a que estas plantas tienen respuestas consistentes y distintivas a las infecciones virales en condiciones de invernáculo, es común usarlas como plantas indicadoras (Walkey 1991). Los dos tipos principales de respuesta son lesiones localizadas (Figura 12), que están confinadas a las hojas inoculadas (hospedantes de lesiones localizadas), y las infecciones sistémicas que producen síntomas en hojas distantes del sitio de inoculación (hospedantes sistémicos). Muchos de los virus vegetales son transmisibles a plantas indicadoras por medio de transmisión mecánica (Figura 25) o por injertos.

Figura 25 |
-
Transmisibilidad. Ensayos de transmisión por vectores. Debido a la especificidad del vector, la identificación del organismo que transmite al virus provee información importante para la identificación del virus.
-
Arquitectura de las partículas virales. Microscopía electrónica. La forma y tamaño de los viriones diferencia partículas en forma de barra, filamentosas, icosaédricas o partículas grandes con envoltorios (Figuras 1-5). Por el contrario, es difícil distinguir a los virus que tienen la misma forma y tamaño. Por ejemplo, es difícil distinguir entre pequeños virus esféricos, y entre estos y los ribosomas vegetales.
-
Presencia de estructuras especificas del virus en células infectadas Microscopía electrónica. Debido a su íntima asociación con los componentes celulares, frecuentemente los virus producen, como resultado de la infección, estructuras inusuales dentro de las células vegetales. Por ejemplo, los virus de la familia
Potyviridae producen inclusiones en forma de “rueda de molino” (Figura 26) características de los virus de esa familia pero que no se encuentran ni en células sanas ni en células infectadas con otros virus. Las inclusiones específicas de los virus han sido caracterizadas en un gran número de familias y géneros de virus, y la detección de estas inclusiones indica la presencia de un virus perteneciente a dicho grupo.

Figura 26 |
-
Propiedades de la cubierta proteica. Técnicas inmunológicas. Estos experimentos se basan en la identificación de un virus (el
antígeno) a través de la reacción con sus
anticuerpos específicos. Los anticuerpos específicos son producidos por un animal cuando proteínas foráneas son introducidas en éste. Para obtener anticuerpos que reaccionen específicamente con un virus vegetal en particular, los investigadores inyectan una preparación purificada del virus vegetal en el animal (generalmente un ratón o conejo). Varias semanas después de la inyección, se colecta la sangre del animal y los anticuerpos se separan de ella. Estos anticuerpos reaccionan específicamente con las proteínas virales que fueron inyectadas en el animal, y los investigadores usan la ventaja de esta interacción específica para diseñar técnicas de laboratorio para la detección de estos virus vegetales.
Uno de los métodos más utilizados para el diagnóstico de virus vegetales está basado en el uso de anticuerpos. Este método es el ensayo de inmunoabsorción de enzima ligada, o ELISA (nota del traductor: del inglés: “Enzyme-linked immunoabsorbent assay”). Un ejemplo de uno de los tipos del método de ELISA se ilustra en la Figura 27. En este ensayo, un extracto de tejido vegetal en evaluación para la presencia de virus se incuba en uno de los orificios o pocitos (“wells”) de una placa plástica microtitulada, y los viriones presentes en el extracto se unen a la superficie del orificio. Luego, el anticuerpo del virus es agregado al pocito y el anticuerpo se une a las partículas virales. Un segundo anticuerpo que ha sido conjugado, o ligado, a una enzima es agregado al pocito donde se une al primer anticuerpo. Después de un lavado para remover el conjugado no ligado de enzima-anticuerpo, se agrega un sustrato incoloro para la enzima. La enzima procesa el sustrato produciendo un compuesto coloreado (por ejemplo, amarillo). La presencia del color indica la presencia del virus, y la intensidad del color puede usarse para estimar la concentración viral. El método ELISA es, por lejos, la técnica inmunológica más utilizada en agricultura para la identificación de virus.

Figura 27 |
-
Propiedades de los ácidos nucleicos virales. Amplificación por PCR. La reacción en cadena de la polimerasa (nota del traductor: PCR, del inglés: Polymerase Chain Reaction) es una técnica muy sensible y específica para la detección de virus. Está basada en la presencia de secuencias únicas en el ácido nucleico del genoma de cada virus (Bartlett 2003). La secuencia del ADN viral que un investigador quiere amplificar es sometida a alrededor de 30 ciclos de copiado en un pequeño tubo de ensayo. Un ejemplo de un tipo de prueba de PCR se ilustra en la Figura 28. En la prueba de PCR, pedazos cortos de ADN (cebadores, o “primers”) complementarios a porciones específicas del ácido nucleico viral se hibridan (adhieren) al ácido nucleico viral. Una enzima polimerasa termoestable es usada para sintetizar múltiples copias de una hebra de ADN (cADN) que es complementaria a la porción de la secuencia del ácido nucleico viral comprendida entre los dos cebadores. Durante la reacción de PCR, el número de moléculas de la secuencia de interés se duplica con cada ciclo, y después de 30 ciclos el resultado es más de 10 billones de copias de dicha secuencia. El producto de la PCR puede detectarse usando electroforesis en gel, proceso en el cual una corriente eléctrica se utiliza para separar en un gel a las moléculas de diferente tamaño. Luego de la separación, los fragmentos de ADN en el gel se tiñen con un pigmento específico para ácidos nucleicos, y la presencia de una banda del tamaño apropiado indica la presencia del virus para el cual los cebadores de ADN fueron diseñados. Para los virus de ARN, la hebra de ARN es “retro”-transcripta a su ADN complementario, seguido de una amplificación del ADN resultante usando la técnica de PCR.

Figura 28 |
Manejo de enfermedades virales vegetales
A pesar de que prácticamente no existen compuestos antivirales capaces de curar las enfermedades virales en las plantas, las medidas de control eficientes pueden mitigar o prevenir sustancialmente su ocurrencia. El primer paso requerido para el manejo de enfermedades virales es la identificación del virus. La estrategia de manejo subsiguiente dependerá de la forma por la cual un determinado virus ingresa al cultivo, de cómo el virus es transmitido entre las plantas de un mismo cultivo, y de cómo el virus sobrevive en ausencia del cultivo (Haddidi et al. 1998). Medidas preventivas incluyen el uso de semillas u órganos vegetativos certificados libres de virus, la eliminación de los posibles reservorios del virus en la vegetación silvestre circundante, y la modificación de prácticas de siembra y cosecha. Si el virus tiene un vector de transmisión conocido, el control o exclusión del vector es sumamente importante. Por ejemplo, los nematodos, insectos y hongos vectores pueden controlarse con nematicidas, insecticidas y fungicidas, respectivamente.
Una estrategia alternativa para el control de virus es la utilización de resistencia a la infección viral, sea natural o modificada por ingeniería genética. Si existen, los genes naturales de resistencia viral pueden introducirse a las variedades de un cultivo por técnicas de mejoramiento convencional. Frecuentemente, estos genes naturales de resistencia se encuentran en los distintos cultivares disponibles de un cultivo determinado. También, los genes de resistencia se encuentran en plantas silvestres identificadas cerca del centro de origen del cultivo en cuestión. La ingeniería genética -la transferencia de genes entre organismos específicos usando enzimas y técnicas de laboratorio y no la hibridación biológica- permite la introducción de dichos genes en especies no emparentadas entre sí. Más aún, la resistencia viral puede diseñarse modificando el sistema de defensa de silenciamiento de ARN en la planta. Esto se consigue introduciendo fragmentos del ácido nucleico viral en los cromosomas vegetales. Tal resistencia transgénica confiere inmunidad a la infección del virus a partir del cual dicho ácido nucleico fue originado. La efectividad de este tipo de resistencia transgénica se pone de manifiesto por el manejo exitoso del virus del anillado de la papaya (Papaya ringspot virus) en Hawaii (Gonsalves et al. 2004). A pesar de que la ingeniería genética ofrece oportunidades ilimitadas para la obtención de cultivos vegetales resistentes a virus, su aplicación en gran escala ha enfrentado cierta resistencia por parte de los investigadores, agencias de control y el público en general. Para poder estimar si las plantas genéticamente modificadas para resistencia a virus son seguras, se necesita primero entender en profundidad los riesgos potenciales asociados con la liberación de plantas genéticamente modificadas al ambiente.
Viroides: Ácidos nucleicos infecciosos
Los viroides son ARNs infecciosos capaces de producir numerosas enfermedades vegetales de importancia económica (Hull 2002). Estos patógenos son similares a algunos virus vegetales ya que su genoma contiene ARN, pero difieren de los virus de ARN en dos aspectos fundamentales. Primero, los viroides están compuestos de ARNs ”desnudos”, es decir, no poseen cubierta proteica. Segundo, los viroides no producen ningún tipo de proteínas cuando infectan a una célula vegetal, más allá de que estén formados por ARN. El genoma de los viroides es una molécula de ARN pequeña y circular que contiene entre 246 y 375 nucleótidos. Aunque los viroides no producen sus propias proteínas, son capaces de usar la maquinaria celular del hospedante para reproducir su propio ARN y moverse dentro de otras células para luego infectar a toda la planta.
Muchos años antes de que se descubriera que los viroides son patógenos especiales y diferentes a los virus vegetales, las enfermedades causadas por viroides eran clasificadas como enfermedades virales. Una razón para esta confusión es que los tipos de síntomas inducidos por viroides en las plantas son similares a aquellos inducidos por virus vegetales. Estos síntomas pueden verse listando los nombres imaginarios otorgados a ciertos viroides (cabe mencionar que los viroides se nombran de manera similar a los virus vegetales, con la diferencia de que el nombre terminar en “d”): el viroide del tubérculo ahusado de la papa (Potato spindle tuber viroid, PSTVd), el viroide de la piel cicatrizada de la manzana (Apple scar skin viroid, ASSVd) (Figura 29), el viroide de la quemadura de sol del aguacate (o palto) (Avocado sunblotch viroid, ASBVd), y el viroide del cancro pustuloso de la pera (Pear blister canker viroid, PBCVd) A pesar de ser muy pequeños, la importancia económica de los viroides puede resultar devastadora. Se estima que más de 30 millones de palmas cocoteras en las Filipinas han muerto como resultado de la enfermedad causada por el viroide cadang-cadang del cocotero (Coconut cadang-cadang viroid, CCCVd) (Figura 30 ).

Figura 29 |

Figura 30 |
Los viroides se clasifican en dos grandes familias,
Pospoviroidae y
Avsunviroidae, dependiendo del lugar de la célula en el cual se replica el viroide (Tabler and Tsagris, 2004). Los viroides de la familia
Pospoviroidae se replican en el núcleo mientras que los viroides de la familia
Avsunviroidae se replican el cloroplasto. Debido a que los viroides no producen ninguna de sus propias proteínas, dependen de alguna de las ARN polimerasas de la planta y de otras proteínas vegetales para su replicación.
Las pruebas de diagnóstico que se utilizan para la detección de viroides no están basadas en ensayos inmunológicos debido a que los viroides no producen ninguna proteína durante la infección. Los protocolos de diagnóstico para los viroides se basan en ensayos biológicos, tales como la transmisión mecánica a plantas indicadoras que producen síntomas de utilidad diagnóstica, y en técnicas de detección basadas en el ARN del viroide. Las pruebas basadas en los ácidos nucleicos incluyen la electroforesis en gel para detectar el ARN del viroide, pruebas de hibridación de ácidos nucleicos y pruebas por la reacción en cadena de la polimerasa (PCR).
Los viroides se diseminan de una planta a otra a través de propagación vegetativa, contaminación mecánica, por polen o por semilla. Las estrategias de manejo de enfermedades causadas por viroides son similares a aquellas usadas para las enfermedades virales, e incluyen el uso de material de propagación y semilla libre de viroide, la prevención de contaminación mecánica y el uso de plantas resistentes a la infección de viroides.
Conclusiones
Los virus vegetales y los viroides son grupos de agentes fitopatógenos diversos e inusuales que infectan y causan enfermedades en muchos cultivos vegetales. Debido a que estos patógenos dependen de la maquinaria celular normal de sus hospedantes para poder reproducirse, es difícil eliminarlos sin dañar al hospedante. Por lo tanto, la mayor parte de estrategias de manejo para las enfermedades causadas por virus vegetales y viroides están apuntadas a prevenir la infección de la planta.
Referencias
Bartlett, J. 2003. PCR Protocols. Humana Press. Totowa, NJ.
Bowers, J.H., B.A.Bailey, P.K. Hebbar, S. Sanogo, and R.D. Lumsden. 2001. The impact of plant diseases on world chocolate production. Online. Plant Health Progress DOI:10.1094/PHP-2001-0709-01-RV. https://www.apsnet.org/edcenter/disandpath/viral/pdlessons/Pages/BarleyYelDwarf.aspx
D'Arcy, C.J. and L.L. Domier. 2000. Barley yellow dwarf. The Plant Health Instructor. DOI:10.1094/PHI-I-2000-11-03.
Ford, R. and T. Evans. 2003.
Tobacco mosaic virus. The Plant Health Instructor. DOI: 10.1094/PHI-K-2003-0528-01. https://www.apsnet.org/edcenter/disandpath/viral/labexercises/TobaccoMosaicVirus/Pages/default.aspx
Gonsalves, D., C. Gonsalves, S. Ferreira, K. Pitz, M. Fitch, R. Manshardt, and J. Slighton. 2004. Transgenic virus resistant papaya: from hope to reality for controlling
Papaya ringspot virus in Hawaii. https://www.apsnet.org/edcenter/apsnetfeatures/Pages/PapayaRingspot.aspx
Gray, S., and Gildow, F. 2003. Luteovirus-aphid interactions. Annual Review of Phytopathology 41: 539-566.
Haddidi, A., R.K. Khertarpal, and H. Koganezawa, (eds.). 1998. Plant Virus Disease Control. APS Press, St. Paul, MN.
Hull, R. 2002. Matthews' Plant Virology. 4th Edition. Academic Press, San Diego, CA.
Levy, L., V. Damsteegt, R. Scorza, and M. Kolber. 2000. Plum pox potyvirus disease of stone fruits. https://www.apsnet.org/edcenter/apsnetfeatures/Pages/PlumPoxPotyvirus.aspx
Pirone, T.P. and S. Blanc. 1996. Helper-dependent vector transmission of plant viruses. Annual Review of Phytopathology 34: 227-247.
Pogue, G.P., J.A. Lindbo, S.J. Garger, and W.P. Fitzmaurice. 2002. Making an ally from an enemy: plant virology and the new agriculture. Annual Review of Phytopathology 40: 45-74.
Scholthof, K-B.G. 2000. Tobacco mosaic. The Plant Health Instructor. DOI:10.1094/PHI-I-2000-1010-01. https://www.apsnet.org/edcenter/disandpath/viral/labexercises/TobaccoMosaicVirus/Pages/default.aspx
Scholthof, K.-B. G. 2001. 1898 – the beginning of virology…time marches on. The Plant Health Instructor. DOI:10.1094/PHI-I-2001-0129-01. https://www.apsnet.org/edcenter/disandpath/viral/labexercises/TobaccoMosaicVirus/Pages/default.aspx
Sherwood, J.L., T.L. German, J.W. Moyer, and D.E. Ullman. 2003. Tomato spotted wilt. The Plant Health Instructor. DOI:10.1094/PHI-I-2003-0613-02. https://www.apsnet.org/edcenter/disandpath/viral/pdlessons/Pages/TomatoSpottedWilt.aspx
Tabler, M. and M. Tsagris. 2004. Viroids: petite RNA pathogens with distinguished talents. Trends in Plant Science 9: 339-348.
Walkey, D. 1991. Applied Plant Virology. 2nd edition. Chapman and Hall, London.
Walmsley, A.M. and C.J. Arntzen. 2000. Plants for delivery of edible vaccines. Current Opinion in Biotechnology 11: 126-129.
Wassenegger, M., and T. Pélissier. 1998. A model for RNA-mediated gene silencing in higher plants. Plant Molecular Biology 37: 349-362.
Wintermantel, W.M. 2004. Emergence of greenhouse whitefly (Trialeurodes vaporariorum) transmitted Criniviruses as threats to vegetable and fruit production in North America.
http://www.apsnet.org/publications/apsnetfeatures/Pages/GreenhouseWhitefly.aspx
Zaitlin, M. 1998. The discovery of the causal agent of tobacco mosaic disease. Pages 105-110 in: Discoveries in Plant Biology. S.D. Kung and S.F. Yang, eds. World Publishing Co. Ltd. Hong Kong.