Fry, William E. and Niklaus J. Grünwald. 2010. Introducción a los Oomicetes. Trans. Alberto J. Valencia-Botín. 2012.
The Plant Health Instructor. DOI:10.1094/PHI-I-2012-0220-01
Autores
William E. Fry y Niklaus J. Grünwald
Cornell University y USDA-ARS
Traducción
Alberto J. Valencia-Botín. Departamento de Ciencias Básicas, Cuciénega, Universidad de Guadalajara, Ocotlán, Jalisco México.
Los oomicetes, también conocidos como "mohos acuáticos", son un grupo de varios cientos de organismos que incluyen algunos de los patógenos más devastadores. Las enfermedades que causan incluyen tizón de plántulas, damping-off, pudrición de raíces, tizones foliares y mildius vellosos. El tizón tardío de la papa, el mildiú velloso de la vid, la muerte súbita del roble y la pudrición de la raíz y tallo de la soya son notables enfermedades causadas por oomicetes. Los fitopatólogos consideraron por largo tiempo a los oomicetes como hongos inferiores, debido a su hábito de crecimiento filamentoso, a su nutrición por absorción y a su reproducción vía esporas. Sin embargo, conforme se ha incrementado el entendimiento de las relaciones evolutivas, es ahora claro que este grupo de organismos no está relacionado con los hongos verdaderos. Ciertamente, los hongos parecen estar más cercanamente relacionados con los animales que con los oomicetes, y éstos a su vez se relacionan más con las algas y las plantas verdes (Figura 1).
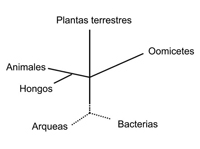
Figure 1.
Los análisis filogenéticos utilizando genes y regiones intergénicas han confirmado los aciertos de los taxónomos pioneros quienes afirmaron que los oomicetes son diferentes de los hongos verdaderos. Los resultados de éstos análisis moleculares han sido particularmente convincentes para los fitopatólogos tradicionales.
Existen muchas características que distinguen a los oomicetes de los hongos. Las septas (paredes celulares) en las hifas son raras, resultando en una condición multinucleada (llamada cenocítica). Los núcleos de las células vegetativas son típicamente diploides. La pared celular se compone de β-1,3 y β-1,6 glucanos y no de quitina (el polímero de N-acetil glucosamina, que se encuentra en las paredes de los hongos verdaderos). Muchas especies producen esporas acuáticas (zoosporas) carentes de pared celular, biflageladas contenidas en estructuras llamadas esporangios.
Características morfológicas de los oomicetes
Una de las características más distintivas es la producción de
zoosporas producidas en
esporangios. El flagelo anterior de una zoospora es de tipo pincel, mientras que el flagelo posterior es de tipo látigo; ambos se unen típicamente a un surco ventral (Figura 2). A pesar de la carencia de pared celular, las zoosporas mantienen consistencia y flexibilidad en su forma. Las zoosporas se encuentran inmersas en películas de agua en la superficie de las hojas, en agua en el suelo, en medios hidropónicos y en cuerpos naturales de agua. Los oomicetes frecuentemente pueden ser "atrapados" en el agua en el suelo, o en arroyos y estanques, por lo que se considera que las zoosporas son atraídas por diferentes cebos-carnadas. Luego de un tiempo de nadar libremente en el agua las zoosporas permanecen en la superficie, retraen sus flagelos, y secretan una matriz mucilaginosa la cual las adhiere a la superficie. Los esporangios de diferentes taxones dentro del grupo presentan diferentes figuras y características (Figuras 3-8, 29). Ellos pueden ser terminales o intercalares (dentro de un filamento hifal), bulboso o no, y si es terminal es caduco (los esporangios se desprenden fácilmente) o no.
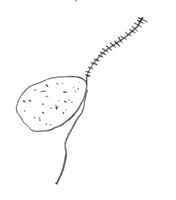
Figure 2. |
Figure 3. |
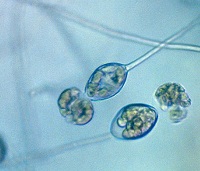
Figure 4. |
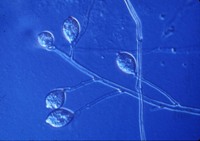
Figure 5. |
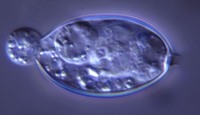
Figure 6. |
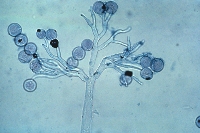
Figure 7. |
En algunas especies, la habilidad para producir zoosporas se ha perdido, y se ha pensado que los esporangios han evolucionado dentro de estructuras que germinan directamente para producir tubos germinativos. En este caso, los esporangios son llamados algunas veces "conidios". En otras especies, los esporangios germinan directamente para producir tubos germinativos o "indirectamente" para producir zoosporas, una característica frecuentemente dependiente de la temperatura, produciéndose las zoosporas a temperaturas más frías.
La reproducción sexual ocurre vía la producción de gametangios: oogonios y anteridios. Debido a que la meiosis no ocurre hasta la formación de los gametangios, el núcleo vegetativo es diploide. La morfología de la unión al anteridio ha sido una importante característica en la taxonomía morfológica de ciertos géneros. En algunos, el anteridio se une a un costado del oogonio (parágino, Figura 8), pero en otros géneros, el anteridio rodea la base del oogonio (anfígino, Figura 9).
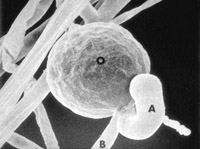
Figure 8. |
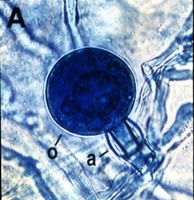
Figure 9. |
Típicamente cada individuo produce tanto anteridios como oogonios, con algunas diferencias en "feminidad" y "masculinidad" y la preferencia sexual es relativa a otros individuos. En algunas especies, dos distintos tipos de apareamiento ocurren y ambos se requieren para la reproducción sexual (estos son heterotálicos, opuesto a especies homotálicas). En especies de oomicetes heterotálicos, los gametangios se producen únicamente en presencia de ambos tipos de apareamiento debido al hecho de que una hormona que se produce por un talo estimula al otro a producir gametangios. En otras especies, la reproducción sexual ocurre dentro de un simple individuo (estos son individuos homotálicos). A diferencia de especies heterotálicas, los individuos homotálicos no requieren distintos tipos de apareamiento, pues pueden reproducirse sexualmente por ellos mismos. Todas las especies de
Pythium y algunas de
Phytophthora son homotálicas.
El oogonio fecundado se desarrolla en una oospora con pared gruesa (Figura 10). Cuando las oosporas se producen en el tejido de la planta, ellas pueden ocupar una extensa porción del tejido (Figura 11). Las oosporas de muchas especies han mostrado la capacidad de sobrevivir por años en el suelo.
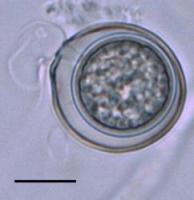
Figure 10. |

Figure 11. |
Después de un período de dormancia (con frecuencia de duración indefinida y aparentemente diversa) las oosporas germinan para producir una hifa, la cual puede inmediatamente producir un esporangio (Figura 12). La germinación de la oospora es frecuentemente asíncrona; esto es, algunas oosporas germinan mientras que otras no lo hacen. La germinación y sobrevivencia de las esporas es dependiente de las condiciones del ambiente: generalmente, las oosporas son capaces de sobrevivir en condiciones secas y frías o sólo en condiciones frías, pero son sensibles a altas temperaturas (> 40-45 ºC).
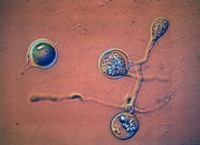
Figure 12.
Algunas especies producen estructuras de sobrevivencia con paredes gruesas llamadas clamidosporas (Figura 13).
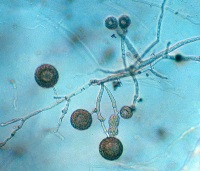
Figure 13.
Relación dentro del grupo de los oomicetes
Nuestra comprensión de las relaciones entre oomicetes está evolucionando rápidamente a medida que obtenemos información adicional, particularmente de análisis moleculares. Las técnicas han evolucionado rápidamente y los análisis de la secuencia de DNA provee un criterio común para evaluar las relaciones. El análisis de relaciones probables entre los principales géneros de oomicetes se representa en la Figura 14. Mientras que
Pythium,
Phytophthora y
Peronospora aparecen relacionadas, la relación de estos organismos con el mildiú velloso del césped permanece en discusión.
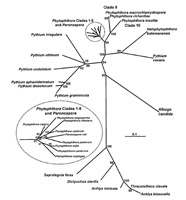
Figura 14.
Dick (2001. Straminipilous Fungi: Systematics of the
Peronosporomycetes including accounts of the marine straminipilous protists, the plasmodiophorids and similar organisms. Dordrecht, Boston, Kluwer Academic Publisher.) ha reportado dos subclases, con seis órdenes de importancia. La tabla de abajo identifica algunos de los géneros en varios órdenes:
Subclase: Peronosporomycetidae
Orden: Peronosporales
Ej: Varios géneros de mildius vellosos,
Albugo
Orden: Pythiales
Ej:
Pythium,
Phytophthora
Subclase: Saprolegniomycetidae
Orden: Saprolegniales
Ej:
Aphanomyces
Orden: Sclerosporales
Ej: Mildius vellosos de Poaceae, tales como:
Sclerospora, Peronosclerospora,
Sclerophthora
Orden: Salilagenidiales
Ej:
Lagena
Orden: Leptomitales
Avances interesantes de la investigación en oomicetes
Varios de los últimos descubrimientos y acontecimientos importantes han tomado a la comunidad de investigadores de oomicetes por sorpresa. Un importante desarrollo es que los genomas de varias especies de oomicetes han sido secuenciados (Hyaloperonospora arabidopsidis,
Phytophthora sojae,
P. ramorum,
P. infestans y
Pythium ultimum) o se encuentran en proceso de secuenciación (P. capsici,
P. parasitica,
Saprolegnia parasitica).
Un descubrimiento es que el grupo de proteínas (efectores) que son secretados por oomicetes y liberados dentro de las células del hospedante; son proteínas que específicamente ayudan en la patogenicidad. Estas proteínas fueron originalmente investigadas como productos de los genes de "Avirulencia" (se llamaron inicialmente genes de "Avirulencia" debido a que se detectaron como sitio de reconocimiento de algunos genes
R del hospedante; reconocimiento que resultaba en avirulencia).
Los efectores se reconocen actualmente como motivos de ubicación de aminoácidos (RxLR-dEER, donde R, L y E corresponden para los aminoácidos arginina, leucina y ácido glutámico), y se ha demostrado que estos motivos se requieren para la secreción y liberación dentro de las células del hospedante. Cada genoma secuenciado contiene cientos de efectores predecibles. La disponibilidad de secuencias del genoma también facilita investigaciones dentro de genes involucrados en la biología básica del desarrollo. Genes específicos para esporulación y de origen de las zoosporas han sido determinados y su función está siendo probada. Finalmente, existen varios avances a nivel poblacional.
Phytophthora ramorum ha emergido de la noche a la mañana como un patógeno muy importante que causa la muerte súbita del roble y otras enfermedades con un sorprendente amplio rango de hospedantes. Recientes migraciones globales de
P. infestans han cambiado la historia de la vida de ese organismo en varios localidades de Europa. Varios nuevas especies híbridas de
Phytophthora que ocurren naturalmente han sido identificadas e incluyen completamente nuevas especies patogénicas y no patogénicas como por ejemplo
P. alni. Una de las especies de interés académico es
Hyaloperonospora arabidopsidis (previamente conocido como
Peronospora parasitica) la misma que ha llegado a ser un modelo de patógeno debido a que infecta al modelo de planta
Arabidopsis.
Notables oomicetes fitopatógenos
Phytophthora infestans, el patógeno del tizón tardío de la papa.
Este es el patógeno que causó la hambruna Irlandesa de la papa a mediados del siglo 19. Se reportó primero en el este de los Estados Unidos justo previo a los reportes de su presencia en Europa. Previo a ese tiempo, no se conocía en la ciencia occidental. Sin embargo, su devastador impacto en papa y a la terrible miseria que causó lo hizo infame. Hojas, tallos y tubérculos son susceptibles (Figura 15, 16). Es una especie heterotálica, con un solo tipo de apareamiento (A1) históricamente dominando la población mundial con la excepción de las poblaciones que existen en México; los dos tipos de apareamiento han existido en la zona central de México por largo tiempo. Sin embargo, a finales del siglo 20 migraciones provenientes de México distribuyeron a Europa una población muy compleja y diversa que contenía los tipos de apareamiento A1 y A2: posteriormente subpoblaciones se distribuyeron desde Europa a otras localidades. Como un organismo asexual en la naturaleza o en la agricultura,
P. infestans es esencialmente un parásito obligado, con mecanismos de sobrevivencia de corto plazo; los tubérculos de papa proveen un mecanismo de sobrevivencia a corto plazo si los tubérculos infectados se almacenan entre ciclos de cultivo. Sin embargo, las relativas recientes migraciones de los tipos de apareamiento A1 y A2 incrementaron las oportunidades de reproducción sexual y la producción de oosporas que representarían mecanismos de sobrevivencia a largo plazo para este devastador patógeno.

Figura 15.
Phytophthora es diferente de otras especies de
Phytophthora en que este es un patógeno aéreo. Esto es, infecta y se reproduce principalmente sobre la parte aérea de su hospedante. Los esporangios son dehiscentes (se caen fácilmente cuando maduran) y bajo condiciones templadas puede sobrevivir un tiempo suficientemente largo y viajar varios kilómetros por medio del aire. El patógeno se ve favorecido en los ambientes húmedos y fríos: la esporulación es óptima a 12-18 °C en ambientes de agua saturada o casi en saturación, y la producción de zoosporas se favorece por abajo de los 15 °C. Las tasas de crecimiento de las lesiones son típicamente óptimas a temperaturas ligeramente cálidas entre los 20 a 24 °C. Bajo condiciones favorables, el ciclo de vida asexual (germinación del esporangio, infección, crecimiento de la lesión, esporulación) puede completarse en menos de cuatro días, pero los síntomas pueden no ser visibles en los primeros 2-3 días después de la infección inicial. La influencia dominante del ambiente en el proceso de infección y esporulación de
P. infestans ha permitido a los investigadores desarrollar varios modelos de predicción para el tizón tardío. Estas investigaciones han resultado en algoritmos (Reglas de Dutch, periodos Beaumont, días favorables de lluvia, valores de severidad, etc), los cuales identifican el ambiente que ha sido favorable para el tizón tardío y permite a los productores predecir condiciones que van a fomentar o conducir la infección. El potencial explosivo de este patógeno es legendario, dramático y real. Cuando la enfermedad está sin control y cuando las condiciones ambientales son favorables para el patógeno, campos de 10-40 acres podrían sucumbir a la enfermedad en pocos días.

Figura 16.
La susceptibilidad general de las papas y los tomates ha estimulado grandes esfuerzos para desarrollar plantas resistentes así como para entender la patogenicidad de
P. infestans. Genes simples de largo efecto para resistencia (R genes) han sido identificados y liberados. Desafortunadamente, debido a la variación de la población del patógeno, el efecto de esos genes no ha sido perdurable. Los genes
R reconocen componentes específicos de las proteínas del patógeno (efectores) que se introducen en las células del hospedante. De llegar a producirse mutaciones en esos efectores capacitarían al patógeno para escapar al reconocimiento y evitar los mecanismos de resistencia. Otros esfuerzos también se han realizado para crear plantas resistentes basados en un mecanismo con menor entendimiento que podría involucrar varios genes. Este mecanismo ha sido llamado resistencia de "campo" o "parcial".
Sin embargo, los cultivares más importantes de papas y tomates son muy susceptibles, necesitando del uso de fungicidas para proteger las plantas.
Una supresión efectiva de la enfermedad requiere una estrategia que integre varias tácticas. Debido a que los tubérculos para semilla pueden ser una fuente del patógeno, es importante plantar únicamente tubérculos sanos. También resulta importante eliminar cualquier tubérculos que ha sobrevivido de un ciclo de cultivo a otro, sobre todo si esos tubérculos sobrevivieron en el suelo o fueron descartados después del almacenaje. Algunas malezas de Solanáceas podrían ser el reservorio del patógeno, por lo que cualquier maleza infectada dentro o cerca del cultivo debe eliminarse. Los fungicidas se usan en armonía con un buen programa de inspección (monitoreo, para conocer si el patógeno está presente) y el momento y dosis de aplicación son a menudo apoyados por datos apropiados de pronóstico.
Plasmopara viticola, el causante del mildiu velloso de la vid
Este patógeno se introdujo a Europa desde Norte América a finales del siglo 19. Fue junto con las plantas silvestres de vid importadas para conferir resistencia al insecto plaga succionador de savia
Phylloxera.
P. viticola es un mildiu velloso heterotálico con sistemas de apareamiento tipo A1 y A2. Las oosporas germinan para producir esporangios con zoosporas, las cuales pueden dispersarse por películas de agua para causar lesiones. Los esporangios de las lesiones primarias (Figura 17, 18) pueden también dispersarse por el viento. Los síntomas en las hojas son pequeñas lesiones amarillas conocidas como manchas de aceite. Las variedades de vid Europeas son susceptibles a
P. viticola y los fungicidas se utilizan extensivamente para suprimir la enfermedad. Los sistemas de predicción se usan para mejorar la eficiencia de la supresión de la enfermedad.

Figura 17.

Figura 18.
Phytophthora cinnamomi, agente causal de la pudrición de raíces por Phytophthora en varias plantas
Este devastador patógeno omnívoro fue aislado por primera vez a inicios del siglo 20, y se piensa que se originó en Papúa Nueva Guinea, pero actualmente tiene una distribución mundial. Se considera que tiene un rango de hospedantes de más de 3,000 especies de plantas. Es heterotálico con sistemas de apareamiento A1 y A2, sin embargo la recombinación sexual no juega un rol significativo en la diversidad poblacional. Con frecuencia, las poblaciones consisten de un solo sistema de apareamiento. Este patógeno infecta raíces fibrosas y puede sobrevivir y crecer saprofíticamente en el suelo. Produce clamidosporas aún en ausencia de reproducción sexual, las mismas que pueden sobrevivir por largos periodos en el suelo.
El ciclo asexual puede ser muy rápido en condiciones húmedas y se describe elegantemente por Hardham (2005. Molecular Plant Pathology 6: 589-604); aquí sólo se presenta un resumen. Los esporangios se producen en esporangioforos y éstos liberan entre 20 a 30 zoosporas. La formación de zoosporas se altera por disminución de la temperatura, resultando en cambios en la expresión de un gran número de genes. Morfológicamente, el citoplasma se delimita en compartimentos uninucleados, con membranas formándose alrededor de cada uno, y éstos a su vez desarrollan flagelos y vacuolas de agua para la expulsión. En
P. cinnamomi, pero no en todas las especies de
Phytophthora, el material de la pared celular en el ápice del esporangio se expande dentro de una vesícula extra-esporangial dentro del cual las zoosporas se liberan. La vesícula es efímera y las zoosporas se liberan rápidamente en el ambiente. Estas pueden viajar distancias que van desde varios centímetros y son atraídas hacia los potenciales sitios de infección en donde se enquistan. Posteriormente, un material mucilaginoso es secretado sobre la superficie que le sirve para fijarse (el quiste) a la superficie del hospedante a pocos minutos del arribo e inmediatamente forma una pared celular. La germinación ocurre rápidamente después del enquistamiento y los tubos germinativos penetran la epidermis de la raíz. La colonización del tejido del hospedante progresa y en tejidos susceptibles, la esporulación ocurre dentro de los tres días.
El patógeno es una amenaza para plantas nativas como agrícolas. Australia es una de las áreas más seriamente afectadas (Figura 19) en donde el patógeno fue introducido a inicios del siglo 20. Aparentemente fue introducido con plantas importadas y se escapó hacia los bosques de eucalipto, el "jarrah", y la enfermedad ha sido denominada "muerte regresiva del Jarrah". Además del
Eucalyptus, muchas otras especies nativas también son susceptibles a este patógeno y la enfermedad es severa actualmente. Desafortunadamente, la construcción de caminos forestales ha demostrado ser un mecanismo de transporte de este patógeno en los bosques. La enfermedad es más severa bajo condiciones húmedas y templadas, y la reducción de la enfermedad está asociada con climas más fríos y secos. Sin embargo, investigadores están esperando que el rango de este patógeno se extienda más hacia el norte en el hemisferio norte en respuesta al cambio climático global. En plantas agrícolas, los fungicidas a base de fosfonatos (efectivos contra oomicetes, pero inefectivos contra hongos) han sido particularmente útiles para suprimir la enfermedad y se usan extensivamente. La resistencia del hospedante también ha sido investigada con algunos limitados éxitos.

Figura 19.
Phytophthora ramorum, agente causal de la muerte súbita del roble, tizón Ramorum y muerte regresiva de ramas
P. ramorum es el patógeno mejor conocido por la muerte súbita del roble en diferentes especies de éste árbol. También causa el tizón Ramorum y la muerte regresiva de ramas en muchas plantas ornamentales. La enfermedad se descubrió simultáneamente en Europa y en California en los 1990s afectando al roble y plantas de vivero tales como rododendro y viburnum. En los Estados Unidos la enfermedad muerte súbita del roble ganó inmediata notoriedad debido a que dejó una muerte extensiva de robles de California (coast live oak) y roble enano (tan oak) en California (Figura 20a, 20b).

Figura 20a. |

Figura 20b. |
Un aspecto de este patógeno que difiere de muchos otros oomicetes es que
P. ramorum tiene un amplio y diverso rango de hospedantes que incluye robles, árboles de sombra, coníferas y plantas ornamentales maderables. Los síntomas difieren en varios hospedantes (Figuras 21-23) y pueden confundirse con enfermedades causadas por otros organismos o con factores del medio ambiente.

Figura 21. |

Figura 22. |

Figura 23.
A pesar de que el centro de origen no se ha identificado, actualmente los científicos creen que
P. ramorum se introdujo a América del Norte y Europa desde el sitio de donde se importaron las plantas de vivero.
En viveros de US este patógeno se maneja frecuentemente a través de cuarentenas, erradicación (Figura 24) y exclusión: los viveros están intentando de evitar el establecimiento del patógeno por exclusión de éste en sus operaciones y el Departamento de Silvicultura de Oregon intenta erradicar
P. ramorum en el condado de Curry en el sureste de Oregon donde se ha establecido en robles nativos y en laurel (madera de mirto):

Figura 24.
Similar a
P. infestans y
P. cinnamomi, este patógeno tiene dos sistemas de apareamiento (Tabla 1). Para nuestro conocimiento, la reproducción sexual vía apareamiento de A1 y A2 no ha sido documentada pero se considera posible donde ambos tipos de apareamiento coexisten. El patógeno existe actualmente como tres clones distintos (linajes clonales) que se reproducen asexualmente: EU1, NA1 y NA2. El linaje EU1 se descubrió primero en Europa pero ahora ha sido también descubierto en US y Canadá en ambientes de vivero selectos. NA1 fue el primer linaje encontrado en causar mortalidad significativa en bosques de roble de California y roble enano en California y Oregon dispersándose en todo Norte América. El tercer clon, NA2, se ha encontrado únicamente en viveros en el Este de los US y Canadá.
Tabla 1. Características de los tres principales linajes clonales de
P. ramorum
|
Linaje clonal | |
Distribución actual | |
Hábitat | |
Tipo de apareamiento |
| EU1 | | Europa, Norte América | | Viveros | | A1 |
| NA1 | | Norte América | | Bosques, viveros | | A2 |
| NA2 | | Norte América | | Viveros | | A2 |
Sclerophthora rayssiae
var.
zeae, agente causal del mildiu velloso y mancha estriada del maíz.
Este mildiu velloso es tan importante que es uno de los pocos patógenos de plantas en ser incluidos en la lista de agentes clasificados del USDA-APHIS. La lista se compone de patógenos de plantas no presentes en los US, pero considerados como potenciales amenazas de bioterrorismo a la agricultura de US.
Sclerophthora rayssiae var.
zeae se reportó por primera vez en India, pero también ahora se ha reportado en Myanmar, Nepal, Pakistán e India; la enfermedad ha sido más severa en áreas con abundante precipitación (100-200 cm/año). En India, se han reportado pérdidas anuales de 20 a 90%. La sobrevivencia de este patógeno es por oosporas en semillas infectadas y en suelo o restos de plantas.
El ciclo de la enfermedad involucra tanto la reproducción sexual como asexual. Las oosporas germinan para producir esporangios, los cuales liberan zoosporas que penetran el tejido de la hoja. Las lesiones son inicialmente intervenales y aparecen como estrías cloróticas, cafés o rojizas en las hojas (Figura 25). La esporulación asexual se favorece por temperaturas moderadas (20-25 ºC) y períodos de alta humedad; los esporangios se producen sobre lesiones de la hoja no necrosadas y da una apariencia grisácea-blanquecina. Posteriormente, los esporangios se dispersan a cortas distancias por medio del viento o salpicado del agua de lluvia, y germinan para producir zoosporas o, menos común, para producir un tubo germinativo y así repetir el ciclo. Las oosporas se producen en tejido necrótico y pueden sobrevivir por años en el suelo o en restos de plantas.

Figura 25.
Peronosclerospora philippinensis, agente causal del "Mildiu velloso Filipino" del maíz y otros pastos.
Debido a su devastadora naturaleza y al hecho de que aún no está presente en los US, éste patógeno también ha sido colocado en la lista de agentes clasificados del USDA-APHIS.
Peronosclerospora philippinensis es endémico de las Filipinas donde las pérdidas anuales reportadas son de 40-60%. Este oomicete no produce zoosporas, más bien los esporangios germinan directamente y han sido referidos como conidios. Las infecciones iniciales de las raíces son consideradas consecuencias de las oosporas en el suelo. La mayoría de las infecciones son iniciadas por los esporangios (conidios) producidos en follaje infectado que puede distribuirse a otras plantas donde ellos germinan directamente e inician lesiones locales. Plantas jóvenes y semillas pueden infectarse sistémicamente (Figura 26). Además del maíz, los hospedantes incluyen caña de azúcar y otros pastos, pero las pérdidas en el rendimiento en esos otros hospedantes no están bien cuantificadas.
La severidad de la enfermedad es muy alta en climas tropicales y áreas que reciben 100-200 cm de lluvia anualmente. La epidemia ocurre debido a ciclos secundarios rápidos que son influenciados por alta humedad y temperaturas cálidas (20-25 ºC). El rol de las oosporas en el ciclo de la enfermedad no ha sido determinado.

Figura 26.
Pythium aphanidermatum y
P. ultimum, agentes causales de la pudrición de semillas, damping-off de plántulas y pudrición radicular.
Las especies de
Pythium se conocen mejor por causar enfermedades como el damping-off y la pudrición de semillas que a menudo ocurre poco después de la plantación tan pronto que las plántulas emergen.
Pythium también causa pudrición de raíces en plantas recién emergidas o maduras y puede ocasionar pudriciones blandas en frutos carnosos.
La enfermedad del damping-off afecta plántulas en todo el mundo. Con frecuencia, plántulas jóvenes son destruídas completamente por éste patógeno y el cultivo emerge desigual (Figura 27, 28), llevando a una reducción significativa de la producción. Las plantas emergidas de mayor edad no se ven afectadas significativamente por
Pythium, pero muestran síntomas de pudrición de las raíces.
Varias especies de
Pythium causan damping-off.

Figura 27. |

Figura 28. |
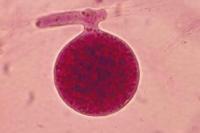
Figura 29.
Pythium insidiosum, un patógeno de animales y humanos causando fitiasis.
Pythium insidiosum causa pitiosis y afecta caballos, gatos y perros y ocasionalmente humanos. La pitiosis se presenta en climas húmedos con inviernos duros. La pitiosis se ha descrito en Australia, Asia así como en Sur, Centro y Norte América incluyendo los US. Generalmente,
P. insidiosum infecta como zoosporas a través de heridas en la piel. Estas zoosporas se enquistan e invaden el tejido animal hospedante. El patógeno puede también infectar a través del tracto gastrointestinal. Para mayor información visitar el enlace: Programa Clerkship de Patología Veterinaria Clínica (http://www.vet.uga.edu/VPP/clerk/stephens/index.php).
Aphanomyces euteiches, agente causal de la pudrición de raíces por Aphanomyces en legumbres.
Aphanomyces euteiches (Figure 30) causes seedling and root-rot diseases on many legumes (Figure 31) and is considered to be the most yield limiting pathogen of pea in some growing areas of the world. The genus
Aphanomyces is particularly interesting because it includes plant and animal pathogens found in both terrestrial and aquatic habitats.
A. euteiches affects a variety of legumes including alfalfa, clover, dry bean, lentil, faba bean, pea, snap bean, and several weed species. This pathogen infects the cortex of primary and lateral roots. Infected areas initially turn honey-brown; as disease progresses the cortex sloughs off and roots turn dark brown to black. Microscopic examination often reveals oospores in the cortex.
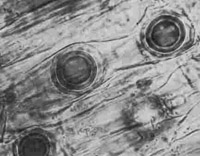
Figura 30a. |
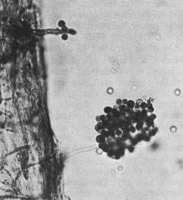
Figura 30b. |

Figura 31.
Como
Pythium spp., este patógeno es capaz de reproducirse sexualmente como oomicete homotálico por medio de la producción de oosporas. En la reproducción asexual, el patógeno produce diferentes esporangios que se diferencían en zoosporas.
Aphanomyces astaci, plaga del cangrejo.
Aphanomyces astaci es un oomicete patógeno que afecta al langostino. Aparentemente, este patógeno se importó dentro de Europa por medio de la descarga de aguas residuales de un barco que provino de Norte América. Este patógeno ha acabado con una gran población del langostino Europeo.
Saprolegnia
Saprolegnia es el único género de patógenos oomicetes que no contienen patógenos de plantas pero contienen patógenos de diferentes organismos transportados por el agua como cangrejos y peces. Sin embargo,
Saprolegnia es considerado patógeno secundario, y dada las circunstancias apropiadas puede actuar como patógeno primario y causar micosis. Típicamente, una vez que un organismo se infecta la enfermedad es fatal. Los científicos creen que una extensa mortalidad del salmón y trucha en Europa ha sido causada por infección de
Saprolegnia.
Saprolegnia puede parasitar aletas y carne, con ventaja en la infección cuando entra a través de heridas. También puede parasitar huevos y es a menudo visible como una masa blanca algodonosa sobre la superficie de los huevos o peces en acuarios caseros.
Recientemente,
Saprolegnia ferax (Figura 32) se le relacionó con la disminución de poblaciones de anfibios. Aparentemente, el cambio del clima indujo la reducción de los niveles de agua, lo cual expuso a los huevos a altos niveles de radiación UV y facilitó la infección por
S. ferax.

Figura 32.
Los esporangios de
Saprolegnia spp. son marcadamente diferentes con el de otros oomicetes por el esporangio alargado y rugoso.
Lecturas adicionales
Cooke, D. E. L., A. Drenth, J. M. Duncan, G. Wagels, and C. M. Brasier. 2000. A molecular phylogeny of
Phytophthora and related oomycetes. Fungal Genetics and Biology 30:17-32.
Fry, W. E., N. J. Grünwald, D. E. L. Cooke, A. McLeod, G. A. Forbes, and K. Cao. 2009. Population genetics and population diversity of
Phytophthora infestans. Pages 139-164 in K. Lamour and S. Kamoun, editors, Oomycete Genetics and Genomics: Diversity, Interactions and Research Tool. Wiley-Blackwell, Hoboken, NJ.
Grünwald, N. J., E. M. Goss, and C. M. Press. 2008.
Phytophthora ramorum: a pathogen with a remarkably wide host range causing sudden oak death on oaks and ramorum blight on woody ornamentals. Molecular Plant Pathology 9:729–740.
Lamour, K. and S. Kamoun, Eds. 2009. Oomycete Genetics and Genomics: Diversity, Interactions and Research Tools. Wiley-Blackwell, Hoboken, NJ.
Tyler, B. M. 2007.
Phytophthora sojae: root rot pathogen of soybean and model oomycete. Molecular Plant Pathology 8:1-8.
Whisson, S. C., P. C. Boevink, L. Moleleki, A. O. Avrova, J. G. Morales, E. M. Gilroy, M. R. Armstrong, S. Grouffaud, P. van West, S. Chapman, I. Hein, I. K. Toth, L. Pritchard and P. R. J. Birch. 2007. A translocation signal for delivery of oomycete effector proteins into host plant cells. Nature 450(7166):115-118.
Dick, M. W. 2001. Straminipilous Fungi: Systematics of the Peronosporomycetes Including Accounts of the Marine Straminipilous Protists, the Plasmodiophorids and Similar Organisms. Kluwer Academic Publishers, Dordrecht, Boston.
Levesque, C. A. and A. W. A. M. de Cock 2004. Molecular phylogeny and taxonomy of the genus
Pythium. Mycological Research 108: 1363-1383.
Hardham, A. R. 2005.
Phytophthora cinnamomi. Molecular Plant Pathology 6:589-604.
Fry, W. E. 2008.
Phytophthora infestans, the crop (and
R gene) destroyer. Molecular Plant Pathology 9:385-402.