Lesiones foliares de color rojizo obscuro en césped bent trepador causados por Colletotrichum cereale.
Síntomas y Signos
Síntomas

Figura 1 |

Figura 2 |

Figura 3 |

Figura 4 |
La pudrición basal ocurre cuando las vainas de las hojas en la base de los entrenudos son colonizadas por el hongo. El tejido infectado se torna de color marrón oscuro a negro, y las hojas se tornan de color anaranjado a amarillo sin presentar lesiones (Figura 5). Los estolones de césped bent trepador también pueden ser infectados (Figura 6).

Figura 5 |

Figura 6 |
Un brote de antracnosis en un green, tee o calle, puede tener una apariencia de manchas definidas (Figuras 7 y 8) o difusas (Figura 9). Los focos de plantas enfermas pueden variar en su tamaño desde pequeños parches irregulares que miden de 1 a 10 cm (>0.5 a 4 pulgadas) a parches mayores de 1 m (> 3 pies). Suelen ocurrir brotes severos cuando el patógeno afecta selectivamente al pasto azul anual que esta invadiendo un green de césped bent trepador (Figuras 9, 10). Sin embargo, la antracnosis puede también desarrollarse en greens de césped bent trepador que no tienen o que tienen una infestación leve de pasto azul anual (Figura 11). El daño en césped bent trepador pueden progresar hasta causar una población pobre de plantas dentro de un mismo parche. La razón de la formación de parches es incierta, pero algunos parches o manchas pueden representar biotipos mas susceptibles de césped bent trepador que se han segregado de otros biotipos de césped bent trepador mas resistentes dentro del green (Figura 12).

Figura 7 |

Figura 8 |

Figura 9 |

Figura 10 |

Figura 11 |

Figura 12 |
Signos
El signo más importante de antracnosis es la presencia aglomeraciones de setae o estromas infectivos de color negro en el tejido de la planta (fructificaciones fúngicas en forma de pelillos, estériles). Las setae pueden observarse con un lente o lupa de una magnificación de 10X y suelen ser abundantes en hojas muertas o secas, vainas de hojas o estolones (Figura 13). Las setas denotan la presencia de acérvulos (Figura 14), los cuerpos fructíferos que producen esporas asexuales (conidias) contenidas en una matriz mucilaginosa (Figura 15). El material mucilaginoso previene el daño por desecación y la germinación prematura de las conidias. Las conidias son hialinas (clara), con forma de media luna y unicelulares (Figura 16). Las conidias pueden confundirse con aquellas de Fusarium spp. y Microdochium nivale (causa del parche por Microdochium), pero las especies de hongos que causan antracnosis normalmente forman conidias que tienen dos o mas células.

Figura 13 |

Figura 14 |

Figura 15 |
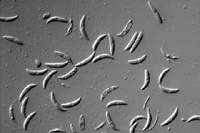
Figura 16 |
Biología del Patógeno
Colletotrichum cereale sobrevive los inviernos como micelio (Figura 17) o conidias asociadas con tejido vegetal infectado previamente. El hongo puede también sobrevivir como agregados de hifas pigmentas de un color negruzco (estromata) que se forman en los estolones y en la base del tallo (Figura 18). La exposición de los estromas a la luz del sol y a temperaturas moderadas de 15°C a 25°C puede inducir la producción de conidias. Las conidias pueden servir como inóculo en la pudrición basal de la antracnosis en la primavera o a inicios del verano. Sin embargo, se requieren investigaciones adicionales para determinar si la forma de antracnosis denominada pudrición basal y la antracnosis foliar son dos enfermedades distintas causadas por diferentes cepas de Collecotricum cereale o simplemente fases de una sola enfermedad. Las conidias se pueden dispersar a hojas adyacentes por medio de la irrigación, la siega y otras prácticas de cultivo que causan un cambio de la estructura física del césped.

Figura 17 |
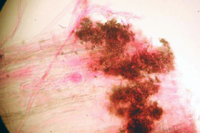
Figura 18 |
De principios hasta mediados de verano durante el período de clima cálido y húmedo, las conidias también pueden germinar en la superficie de las plantas y formar tubos de germinación que se transforman en un apresorio melanizado de forma lobular (Figura 19). El apresorio sirve para sujetar los filamentos de las hifas a la superficie de la planta. Un estilete de penetración sale desde un poro en el apresorio y penetra directamente en las células epidérmicas de la planta. La penetración de la epidermis es seguida muy cercanamente por la producción de una hifa infectiva que tiene una forma irregular. Luego una o más ramificaciones de la hifa infectiva invaden células cercanas del mesófilo. Desde este punto, Collectotrichum cereale se comporta como un organismo necrotrófico, destruyendo tejido de las plantas con enzimas, y posiblemente toxinas, al momento de que el micelio coloniza la planta. El estado sexual (teleomorfo) de C. cereale es el ascomiceto Glomerella graminicola. Este estado se ha observado en cultivos de laboratorio pero no en céspedes infectados.
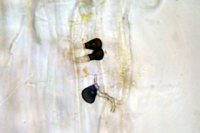
Figura 19 |
Ciclo de la enfermedad y epidemiología
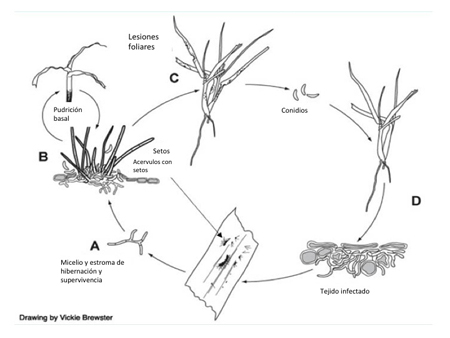
Epidemiología
La antracnosis se desarrolla dentro de un rango amplio de temperaturas. Los síntomas de la pudrición basal se desarrolla a temperaturas mas frescas (15 a 25°C, o 60 a 78°F), mientras que los síntomas foliares ocurren a temperaturas superiores a los 26°C (79°F). Los brotes de la antracnosis foliar se han podido predecir usando una combinación de la duración de humedad en la hoja y la temperatura ambiental. Para la infección se necesita una humedad continua sobre la hoja de 12 horas o más y de temperaturas entre 14 y 28°C (57 a 82°F), que se intensifica con un incremento de la temperatura y de la duración de la humedad sobre la hoja. El periodo de latencia (tiempo entre la infección y la producción de nuevas esporas) se piensa que es de 10 a 12 días.
Las plantas juveniles exhiben una buena resistencia a la antracnosis foliar causada por C. cereale. Al madurar las plantas, los síntomas iniciales se desarrollan en las hojas más viejas y en estado de senescencia. En el pasto azul anual (Poa annua), los síntomas de antracnosis foliar se incrementan en severidad tras las antesis (apertura de flores). Se cree que las plantas sometidas a estrés por sequía y/o estrés de fertilidad son más susceptibles a la infección.
Hospedantes específicos. Aislados de C. cereale muestran un grado de especificidad patogénica ya sea hacia pasto azul anual (Poa annua) o hacia césped bent trepador, aunque algunos aislados pueden infectar a ambos hospederos. Análisis de ADN indican que aislados de pasto azul, césped bent trepador y maíz son genéticamente diferentes. Además, similitudes genéticas entre aislados de C. cereale están mas influenciadas por la planta huésped que por origen geográfico. Por ejemplo, aislados de C. cereale procedentes del césped bent trepador y de pasto azul anual pueden diferir en la longitud de apresorio y esporas. Los resultados de un estudio indican que la media de longitud del apresorio fue 0.8 µm mas larga para aislados del césped bent trepador que para aislados de Poa annua. En contraste, la media longitud de la espora fue 1.5 µm más corta para aislados del césped bent trepador que para aislados de pasto azul. Además, cuando se cultivó en agar, el color de las colonias de C. cereale fue influenciado por el tipo de césped. Cultivos negro-grisáceos fueron aislados de césped bent trepador, y cultivos con coloración rosa fueron aislados de pasto azul anual.
Control de la enfermedad
Control cultural
La susceptibilidad al Colletotrichum cereale se acentúa en césped sometido a estrés, como las altas temperaturas, compactación en la zona radicular, acumulación de colchón de materia orgánica, baja fertilidad, sequía, baja altura de siega y ataques de insectos. Las prácticas culturales que pueden reducir estos y otros tipos de estrés a menudo ayudan a limitar la incidencia y severidad de antracnosis. Estas prácticas incluyen la aireación del suelo, reducción de colchón de materia orgánica, uso de equipos de segadoras ligeras, incremento de la fertilización de nitrógeno y riego suficiente para prevenir el estrés por sequía. Para ser eficaz, éstas prácticas de manejo deben ser iniciadas antes del desarrollo de los síntomas de antracnosis. Algunas de estas prácticas culturales tales como la aireación del suelo, escarificado y recebo pueden crear heridas que sirven como sitios de infección de C. cereale. Por lo tanto, es aconsejable un tratamiento fungicida antes de estos procedimientos. Puesto que las esporas de C. cereale necesitan más de 12 horas con humedad continua en las hojas para germinar e infectar, los tratamientos deben realizarse evitando exponer a las hojas a largos periodos de humedad. La superficie de las hojas debe estar seca antes de la caída del sol por la tarde. Se deben podar los árboles y arbustos para permitir la circulación del aire, y pueden colocarse ventiladores estratégicamente alrededor de las zonas donde la circulación de aire es pobre.
Control químico
Varios fungicidas de contacto (p.e., clorotalonil), penetrantes (p.e., trifloxystrobina), y sistémicos (p.e., propiconazol) están registrados para el control de antracnosis. Cada uno de estos fungicidas pueden dar un control preventivo (pre-infección), teniendo en cuenta que solo los fungicidas penetrantes y sistémicos tienen actividad curativa (post-infección). En algunos estados de EEUU, poblaciones de C. cereale han desarrollado resistencia a benzimidazol (p.e., thiofanato de metilo) y a fungicidas QoI (Inhibidores de la parte externa de la quinona/estrobilurinas) (p.e., azoxystrobina, trifloxystrobina, y pyraclostrobina).
Control biológico
Se ha determinado que la hidrofobicidad de la superficie de la hoja en maíz puede inducir la germinación de las esporas de C. cereale en maíz. En el futuro, la selección de un pasto azul anual/Poa annua y agrostis con una cutícula no cérea puede ser una novedosa estrategia para el retraso o interferencia en la germinación de las conidias de C. cereale, tal como se ha sugerido para el maíz.
Importancia
Significado Histórico
En los Estados Unidos, el hongo ahora conocido como Colletotrichum cereale, fue reportado por primera vez en asociación con el pasto azul anual/Poa annua en 1914. En 1928, se describió una enfermedad de Poa annua con tres organismos fúngicos causales. Los organismos descritos son ahora conocidos como C. cereale, Drechslera poae, y Fusarium sp. Para este tiempo se desconocía la importancia de los tres hongos como causantes de la enfermedad. Experimentos llevados a cabo en Inglaterra durante la década de los 50's sugirieron que C. cereale era el responsable de los síntomas de la pudrición basal del pasto azul anual/Poa annua.
A finales de los 1960s, se describió a la antracnosis como una enfermedad foliar importante del pasto azul anual/Poa annua en Carolina del Sur. Sin embargo, la existencia de la enfermedad fue cuestionada, basada en la observación de que la infección de C. cereale estaba asociada a condiciones ambientales de calor y las hojas de césped marchitas. Antes de 1975, la mortalidad de pasto azul anual/Poa annua durante el verano, se consideraba como un desorden fisiológico, y la muerte de la planta se atribuyó a un estrés por el calor de mediodía. En 1976, la antracnosis fue propuesta como uno de los tres componentes del síndrome conocido como "senescencia por antracnosis y helminthosporium". El síndrome definido reflejó la asociación de C. cereale con hongos que causan manchas en las hoja (Bipolaris o Drechslera) y la senescencia o muerte de la hojas mas viejas. A mediados de los 80's, C. cereale confirmó ser un patógeno del pasto azul anual/Poa annua en los Estados Unidos en los cuales se utilizaron y comprobaron los postulados de Koch.
Anterior a los 1970's, la antracnosis fue reportada esporádicamente, en los greens de golf, pero la enfermedad ha llegado a ser más prevalente en las últimas décadas. El incremento en las epidemias de antracnosis en campos de golf en Estados Unidos, coincide con el uso de prácticas culturales que someten a los céspedes a un mayor estrés, tales como la reducción de la altura de siega, aplicaciones muy limitadas de fertilizantes y el crecimiento del césped en suelos compactados.
Bibliografia seleccionada
Backman, P. A., P. J. Landschoot, and D. R. Huff. 1999. Variation in pathogenicity, morphology, and RAPD marker profiles in Colletotrichum graminicola from turfgrasses. Crop Science 39:1129-1135.
Bergstrom, G. C. and R. L. Nicholson. 1999. The biology of corn anthracnose. Plant Disease 83:596-608.
Bolton, A. T. and W. E. Cordukes. 1981. Resistance to Colletotrichum graminicola in strains of Poa annua and reaction of other turfgrasses. Canadian Journal of Plant Pathology 3:94-96.
Browning, M., L. V. Rowley, P. Zeng, J. M. Chandlee, and N. Jackson. 1999. Morphological, pathogenic, and genetic comparisons of Colletotrichum graminicola isolates from Poaceae. Plant Disease 83:286-292.
Burpee, L. 2005. Sensitivity of Colletotrichum graminicola to phosphonate fungicides. International Turfgrass Society Research Journal 10:163-169.
Chaky, J., K. Anderson, M. Moss, and L. Vaillancourt. 2001. Surface hydrophobicity and surface rigidity induce spore germination in Colletotrichum graminicola. Phytopathology 91:558-564.
Couch, H. B. 1995. Diseases of Turfgrasses, 3rd edition. Krieger Publishing Company. Malabar FL.
Crouch, J. A., B. B. Clarke, and B. I. Hillman. 2006. Unraveling evolutionary relationships among the divergent lineage of Colletotrichum causing anthracnose disease in turfgrass and corn. Phytopathology 96:46-60.
Danneberger, T. K., J. M. Vargas, Jr., P. E. Rieke, and J. R. Street. 1983. Anthracnose development on annual bluegrass in response to nitrogen carriers and fungicide application. Agronomy Journal 75:35-38.
Danneberger, T. K., J. M. Vargas, Jr., and A. L. Jones. 1984. A model for weather-based forecasting of anthracnose on annual bluegrass. Phytopathology 74:448-451.
Horvath, B. J. and J. M. Vargas Jr. 2004. Genetic variation among Colletotrichum graminicola isolates from four hosts using isozyme analysis. Plant Disease 88:402-406.
Jackson, N. and V. J. Herting. 1985. Colletotrichum graminicola as an incitant of anthracnose/basal stem rotting of cool season turfgrasses. Proceedings Fifth International Turf Research Conference 5:647-656.
Khan, A. and T. Hsiang. 2003. The infection process of Colletotrichum graminicola and relative aggressiveness on four turfgrass species. Canadian Journal of Microbiology 49:433-442.
Mims, C. W. and L. J. Vaillancourt. 2002. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology 92:803-812.
Smiley, R. W., P. H. Dernoeden, and B. B. Clarke. 2005. Compendium of Turfgrass Diseases, 3rd ed. American Phytopathological Society, St. Paul, MN.
Smith, J. D., N. Jackson, and A. R. Woolhouse. 1989. Fungal Diseases of Amenity Turfgrasses. E. and F. N. Spon Ltd., New York, NY.
Sutton, B. C. 1968. The appressoria of Colletotrichum graminicola and C. falcatum. Canadian Journal of Botany 46:873-876.
Vargas, J. M., Jr. and R. Detweiler. 1985. Anthracnose of Poa annua: the pathogenicity of Colletotrichum graminicola. International Turfgrass Society Research Journal 5:637-640.
Vargas, J. M., Jr., T. K. Danneberger, and A. L. Jones. 1993. Effects of temperature, leaf wetness duration, and inoculum concentration on infection of annual bluegrass by Colletotrichum graminicola. International Turfgrass Society Research Journal 6:324-328.
Vargas, J. M., Jr. 1994. Management of Turfgrass Diseases, 2nd edition. Lewis publishers, Boca Raton, FL.