Sigatoka negra
Mycosphaerella fijiensis – encontrado em quase todas as regiões produtoras de banana.
Musa spp. (bananas em geral)
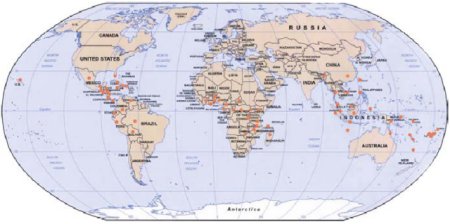
Figura 1. Distribuição mundial da Sigatoka negra (círculo = países nos quais a Sigatoka negra já foi relatada de acordo com Calier et al. [11] e Mourichon et al. [75]. Mapa é cortesia de www.theodora.com/maps, com permissão).
Traduzido por: Armando Bergamin Filho, ESA Luiz de Queiroz, Universidade de São Paulo, Piracicaba-SP, Brasil, e Eduardo Mizubuti, Universidade Federal de Viçosa, Viçosa-MG, Brasil.

Figura 2. A bananeira. Originando-se do pseudocaule está o rácimo que sustenta as flores femininas nas extremidades do fruto partenocárpico e a gema que envolve as flores masculinas sob brácteas púrpuras. (Cortesia de H.D. Thurston).
Sintomas e sinais
Os primeiros sintomas da Sigatoka negra são manchas diminutas e cloróticas que aparecem na face inferior (abaxial) da terceira ou quarta folha aberta. As manchas progridem para estrias finas e marrons e ficam limitadas pelas nervuras (Figura 3). As estrias tornam-se mais escuras, algumas vezes com tom púrpura e visíveis na face superior (adaxial) das folhas. As lesões aumentam em tamanho, tornando-se fusiformes ou elípticas, dando o aspecto estriado característico das folhas doentes (Figura 4). O tecido adjacente à lesão freqüentemente tem aspecto encharcado, especialmente sob condições de alta umidade.
 |
 |
| Figura 3 |
Figura 4 |
Quando a severidade da doença é alta, grandes áreas da folha podem se tornar escuras e encharcadas. No tecido necrosado aparecem numerosos corpos de frutificação globosos (pseudotécios), de tamanho pequeno, negros, que contêm estruturas em forma de saco (ascos). Os ascos estão cheios de ascósporos, que são os esporos sexuais do fungo, que emergirão na parte inferior da folha (Figura 5).
 |
| Figura 5 |
A Sigatoka negra, inicialmente relatada em Fiji em 1964, recebeu esse nome por ser uma forma diferente da Sigatoka amarela. Conforme mencionado anteriormente, na Sigatoka negra, tanto estrias jovens como as lesões são de coloração negra e normalmente não apresentam o característico halo amarelo como nas estrias da Sigatoka amarela. Embora as lesões da Sigatoka amarela (Mycosphaerella musicola) sejam semelhantes, pode-se distinguir entre as Sigatokas negra e amarela observando-se as características do fungo, mais especificamente das hifas (conidióforos) que produzem os esporos assexuais (conídios). As duas espécies podem ser diferenciadas microscopicamente pelo exame da estrutura do conidióforo. Mycosphaerella fijiensis produz conidióforos em pequenos grupos e não em tufos como os esporodóqios produzidos somente por Mycosphaerella musicola. Mycosphaerella fijiensis também apresenta cicatriz na base dos conídios. Mycosphaerella fijiensis produz a maioria de seus esporos assexuais (conídios) e estruturas que produzem seus esporos sexuais (espermogônia) na face inferior da folha, ao passo que Mycosphaerella musicola produz conídios predominantemente na face superior da folha. Sintomas da Sigatoka amarela (Figuras 6 e 7) desenvolvem-se tipicamente mais lentamente que os sintomas da Sigatoka negra (Figura 8) (veja abaixo: Comparação entre Sigatoka negra e Sigatoka amarela). Adicionalmente, a diagnose pode ser feita por meio de PCR.
 |
 |
| Figura 6 |
Figura 7 |
 |
| Figura 8 |
Se não controlada, a Sigatoka negra progride por toda a superfície da folha, reduzindo grandemente sua capacidade fotossintética e, conseqüentemente, a produção (Figura 9).
 |
| Figura 9 |
Comparação entre Sigatoka negra e Sigatoka amarela
| Patógeno |
| SIGATOKA AMARELA |
SIGATOKA NEGRA |
Mycosphaerella musicola
(Pseudocercospora musae) |
Mycosphaerella fijiensis
(Psedocercospora fijiensis) |
- conidióforos formados em feixes densos (esporodóquios), com estroma escuro, em ambas as superfícies foliares
- conidióforos retos, usualmente não-septados e não-ramificados, sem apresentar cicatrizes no esporo
- largura do conídio uniforme em todo o seu comprimento, com 1-5 septos, sem cicatriz basal
|
- conidióforos formados isoladamente ou em pequenos grupos (2-5) na superfície inferior da folha
- conidióforos retos ou curvos, com 0-3 septos, ocasionalmente ramificados, com cicatriz ligeiramente mais larga nos esporos
- conídios mais afilados da base para o ápice, 1-6 septos, cicatriz basal visível
|
| Hospedeiros |
| SIGATOKA AMARELA |
SIGATOKA NEGRA |
| bananas (AAA) geralmente suscetíveis; maioria das bananas para cozinhar e ‘plantains’ (AAB e ABB) moderadamente a altamente resistentes |
maioria das bananas de sobremesa, bananas para cozinhar e ‘plantains’ suscetíveis |
| Sintomas |
| SIGATOKA AMARELA |
SIGATOKA NEGRA |
- estrias iniciais amarelo pálidas
- estrias aparecem nas folhas de número 4-5 (Cavendish não pulverizadas)
|
- estrias iniciais marrom escuras
- estrias aparecem nas folhas de número 2-4 (Cavendish não pulverizadas)
|
| Epidemiologia |
| SIGATOKA AMARELA |
SIGATOKA NEGRA |
- mais comum em ambientes mais frios
- inóculo consiste de ambos, conídios (dispersos pela água) e ascósporos (dispersos pelo vento)
- conídios aparecem primeiramente na lesão madura
- produz mais que 30.000 conídios por lesão
- conídios não são liberados pelo vento
- ascósporos maduros produzidos 4 semanas após o aparecimento da estrias
|
- mais comum em ambientes mais quentes
- ascósporos levados pelo vento são o inóculo mais importante
- conídios aparecem nos estádios iniciais da estria
- produz cerca de 1.200 conídios por lesão
- conídios liberados pela água e pelo vento
- ascósporos maduros produzidos 2 semanas após o aparecimento das estrias
|
Biologia do Patógeno
Reprodução sexual
Mycosphaerella fijiensis é o nome da forma sexual (teleomórfica) do patógeno. O fungo foi descrito pela primeira vez em 1969 por Morelet a partir de espécimes coletados em Fiji.
Para produzir a forma sexual, o fungo inicialmente desenvolve grande número de espermogônios na face inferior da folha à medida que as lesões envelhecem. O espermogônio é escuro (Figura 10) formado próximo à superfície foliar e tem a forma de pêra. Sob condições de alta umidade, essas estruturas produzem grande quantidade de células reprodutivas masculinas (espermácias). As espermácias são pequenas, cilíndricas e vão fertilizar as células femininas vizinhas (tricógenes), formadas em outro espermogônio.
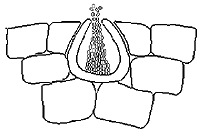 |
| Figura 10 |
Uma vez completada a fertilização, formam-se os pseudotécios dentro das lesões maduras, com seus ostíolos projetando-se através dos tecidos (Figura 11). Os ascos são oblongos ou em forma de clava, têm duas paredes celulares (bitunicados) e contêm oito esporos sexuais (ascósporos) alinhados dois a dois. O pseudotécio não contém pseudoparáfises ou elementos estéreis. Os ascósporos são incolores e têm um septo. Uma das células pode ser ligeiramente mais larga que a outra e o esporo pode ser mais estrito na região do septo. A Figura 12 mostra um pseudotécio.
 |
 |
| Figura 11 |
Figura 12 |
Reprodução assexual
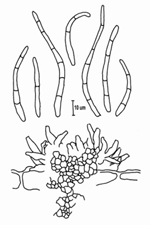
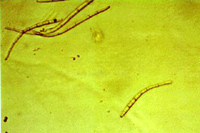
A forma assexual é chamada de Pseudocercospora fijiensis. Conídios são formados isolada e terminalmente nos conidióforos. Os esporos são translúcidos a levemente marrom esverdeados, longos, levemente curvos e têm três ou mais septos. (Figuras 13 e 14).
 |
 |
| Figura 13 |
Figura 14 |
Os conídios germinam durante períodos de alta umidade relativa (92 a 100%) e infectam a folha através dos estômatos, usualmente na face inferior da folha. Em condições de alta umidade, as hifas podem emergir nos estômatos, crescer ao longo da superfície foliar e penetrar outros estômatos, aumentando assim a lesão. Conidióforos emergem dos estômatos, algumas vezes em massas compactas de micélio (estroma). Estromas também podem se desenvolver em espermogônios jovens.
Ciclo da Doença e Epidemiologia
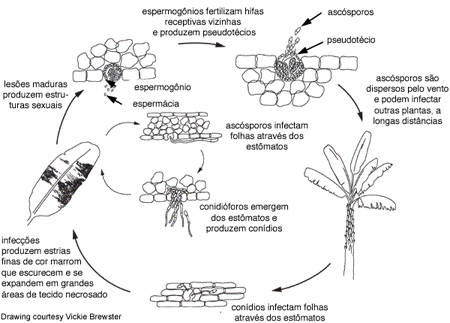 Ciclo da Doença
Ciclo da DoençaEpidemiologia
No caso da Sigatoka negra, os ascósporos são os principais propágulos pelos quais o fungo se dispersa. A dispersão por conídios também ocorre, mas não é tão importante quanto a de ascósporos.
Conídios são formados prontamente sob alta umidade, especialmente na presença de um filme de água sobre a folha. Esses esporos assexuais se dispersam por lavagem ou impacto de gotas de chuva, causando a disseminação local da doença.
Os pseudotécios amadurecem quando o tecido foliar morto se satura com água por aproximadamente 48 horas. Ascósporos são importantes para a dispersão a longa distância e são os mais importantes para a disseminação durante longos períodos de clima úmido. Mycosphaerella fijiensis forma relativamente poucos conídios; assim, considera-se que os ascósporos têm um papel mais relevante no ciclo da doença.
O número de lesões de Sigatoka na folha da bananeira decresce durante a estação seca mas, de qualquer maneira, mantém-se um contínuo ciclo de infecção durante todo o período (Figura 15).
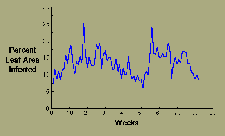 |
| Figura 15 |
Manejo da Doença
Fungicidas
Grandes plantações dependem em larga escala do controle químico, especialmente fungicidas protetores, como mancozeb, usualmente aplicado em água ou em combinação com óleo, e clorotalonil. Mancozeb é freqüentemente combinado ou usado em rotação com morfolina, inibidores de demetilação (DMI), ou estrobilurinas (QoI). Clorotalonil é usado em rotação mas não combinado com outros fungicidas. Resistência a benzimidazóis, DMI e estrobilurinas é bastante comum em muitas áreas de produção. Os fungicidas são freqüentemente aplicados por meio de avião (Figura 16).
 |
| Figura 16 |
Controle biológico
A pesquisa para o desenvolvimento de métodos de controle biológico para a Sigatoka negra é limitada, uma vez que métodos químicos de controle são altamente eficientes e de custo compatível. O controle biológico é um método desejável principalmente por razões ambientais, mas seu uso na prática é de difícil implementação, pois a Sigatoka negra é uma doença policíclica e tecido suscetível do hospedeiro está disponível durante todo o ano. Várias bactérias epífitas (incluindo Pseudomonas, Bacillus e Serratia spp.) têm sido testadas para o controle de M. fijiensis, mas a pesquisa com agentes de controle biológico ainda é incipiente.
Variedades resistentes
O uso de variedades resistentes é o único meio prático de controle da Sigatoka negra para o pequeno produtor e para o agricultor de subsistência, pois os fungicidas são geralmente muito caros para esses agricultores. Infelizmente, a despeito da existência de algumas variedades resistentes, elas são freqüentemente inaceitáveis para o mercado. O desenvolvimento de variedades resistentes aceitáveis é uma prioridade de trabalho nos centros de pesquisa internacionais (Figura 17).
 |
| Figura 17 |
Entretanto, o melhoramento para resistência a doenças é difícil no caso de bananeira. Bananas comerciais são autotriplóides (AAA), isto é, elas têm três cópias dos cromossomos ao invés das duas cópias que os diplóides silvestres possuem. Ao mesmo tempo que este conjunto extra de cromossomos confere às variedades características comerciais favoráveis, como a ausência de sementes (ao contrário das espécies selvagens diplóides, Figura 18) e plantas e frutos maiores, também aumenta o nível de esterilidade. Esse alto nível de esterilidade é o maior obstáculo para os melhoristas. Adicionalmente, o tempo de geração (de semente a semente) para as bananas é longo, podendo alcançar três anos.
 |
| Figura 18 |
Manejo cultural
Técnicas de manejo cultural, tais como maior espaçamento, melhor drenagem e aeração, controle adequado de plantas daninhas e remoção de plantas severamente doentes ou de partes delas, podem também ser usadas para obter algum controle. A simples remoção de folhas infectadas, colocando-as no chão, pode significativamente reduzir a eficiência da dispersão de ascósporos (Figura 19). A aplicação de uréia e de outros produtos nos restos infectados depositados no chão pode acelerar a decomposição e assim reduzir a quantidade disponível de inóculo.
 |
| Figura 19 |
Quarentena e sanitização
Quarentena e sanitização apropriadas podem conferir proteção contra dois meios de transporte de inóculo a longas distâncias – folhas e rizomas infectados. Folhas de bananeira contaminadas são freqüentemente usadas para proteger os frutos quando transportados por caminhões.
Medidas de quarentena são praticadas em algumas áreas e países onde M. fijiensis ainda não se estabeleceu ou está confinada a certas áreas (Figuras 20 e 21).
 |
 |
| Figura 20 |
Figura 21 |
Significância
Danos e impacto econômico
A Sigatoka negra é devastadora. Sob condições favoráveis, a necrose das folhas pode reduzir a produção em 35-50%. Muitas variedades importantes e freqüentemente plantadas são suscetíveis. Em 1995, o custo médio de controle para esta doença foi de 1500 dólares/ha/ano. Anualmente, uma plantação típica requer de 38-50 pulverizações com fungicidas e essas pulverizações são responsáveis por cerca de 30% do custo de produção. Na América Central, a Sigatoka negra é responsável por 27% do custo total de produção, enquanto o custo do controle de outras doenças e pragas representa somente 3-5% do custo total de produção.
Geralmente um mínimo de cinco folhas sobre a planta na colheita é requerido para que a qualidade do fruto permaneça estável durante o transporte. Frutos de plantas severamente atacadas estão sujeitos ao amadurecimento prematuro e desigual. Este é um problema grave para os exportadores, considerando a demanda por produtos de qualidade dos consumidores dos países desenvolvidos.
Grandes produtores podem pagar o preço das pulverizações, mas o mesmo não acontece com o pequeno produtor que, assim, sofre perdas. Este é um sério problema de segurança alimentar para os produtores de subsistência, particularmente para aqueles que dependem em grande parte de uma dieta baseada em bananas. Em certas partes da África, algumas variedades de banana são a principal fonte alimentar (Figura 22).
 |
| Figura 22 |
Referências Selecionadas
International Mycosphaerella Genomics Consortium (IMGC)
Marín, D.H., R.A. Romero, M. Guzman, and T.B. Sutton. 2003. Black Sigatoka: an increasing threat to banana cultivation. Plant Dis. 87:208-222.
Ploetz, R.C., G.Z. Zentmyer, W.T. Nishijima, K.G. Rohrbach, and H.D. Ohr. 1994. Compendium of Tropical Fruit Diseases. American Phytopathological Society Press. St. Paul, MN.
Ploetz, R.C. 1999. Black Sigatoka of Banana: The most important disease of a most important fruit. APSnet feature article: http://publish.apsnet.org/publications/apsnetfeatures/Pages/BlackSigatoka.aspx
Promusa Website:
http://www.promusa.org/
Stover, R.H. 1980. Sigatoka leaf spot diseases of bananas and plantains. Plant Dis. 64:750-756.
Stover, R.H. 1986. Disease management strategies and the survival of the banana industry. Ann. Rev. Phytopathol. 24:83-91.
Thurston, H.D. 1998. Tropical Plant Diseases. American Phytopathological Society Press. St. Paul, MN.