Podridão radicular de Monosporascus e declínio dos ramos do meloeiro (PRM/DR). Também conhecido como murcha (murchidão, pt) súbita, morte súbita, colapso do meloeiro, murcha (murchidão, pt) de Monosporascus, podridão de raiz e podridão radicular da pimenta do reino (pt).
Monosporascus cannonballus Pollack & Uecker
Melão (Cucumis melo L.) e melancia [Citrullus lanatus (Thunb.) Matsum & Nakai] são os principais hospedeiros economicamente importantes. A maioria das cucurbitáceas, incluindo o pepino (Cucumis sativus), a cabaça (Lagenaria siceraria) e Cucurbita spp., são susceptíveis à inoculação artificial, entretanto, raramente a infecção é observada em plantios comerciais. Porém, infecções tem sido observadas em cucurbitáceas sob plantio comercial protegido. Outras plantas não cucurbitáceas foram reportadas como capazes de suportar o crescimento desse patógeno sob condições de inoculação artificial ou no campo sem sintomas tipicos da doença.

Colapso de plantas de meloeiro devido a infecção por Monosporascus cannonballus. (Cortesia R. Martyn)
Sintomas e sinais
Monosporascus cannonballusinfecta as raízes das plantas, tanto as primárias como as secundárias e terciárias. A infecção pode ocorrer logo no início do ciclo de cultivo, mas os sintomas na parte aérea geralmente são visíveis mais tardiamente no ciclo. Os sintomas primários caracterizam-se pela presença de necrose nas radículas e lesões nas raízes maiores, tipicamente em torno da junção das raízes (Figura 1), porém o sintoma mais severo é o colapso do ramo nas últimas etapas do ciclo da cultura (Figura 2).

Figura 1 |

Figura 2 |
A colonização e necrose da raiz continua progredindo durante toda a vida da planta causando crescentes danos ao sistema radicular. Nos casos severos, as raízes maiores, incluindo a pivotante, tornam-se infectadas. Os sintomas apresentados na parte aérea como resultado dos danos às raízes são atrofia da planta e uma morte gradual das folhas a começar pelas folhas do topo. Tipicamente, tarde na estação, o ramo inteiro colapsa (Figura 2). A severidade da doença é aumentada pelo estresse da planta, incluindo a maturidade, carga de frutos, fatores bióticos e abióticos, incluindo outros microorganismos, temperatura do solo, umidade e pH. As plantas doentes têm poucas raízes secundárias e terciárias (Figura 1) e podem ou não apresentar sintomas de uma podridão úmida onde a região do córtex facilmente se descasca. Não há indicação de que a podridão úmida é devida unicamente aM. cannonballus, sendo mais provável ser devida a fungos ou bactérias secundárias presentes no solo que aproveitam o comprometimento das raízes e as condições de umidade do solo.
O primeiro sinal de diagnóstico do patógeno é a formação de peritécios negros, esféricos e eruptivos nas raízes (Figura 3), facilmente visíveis a olho nu ou lentes manuais. Os peritécios são as estruturas de reprodução sexual (frutificações) do fungo e se desenvolvem em toda extensão das raízes secundárias tarde no ciclo da cultura, porém os peritécios são tipicamente mais abundantes poucos dias após a planta (raiz) morrer. Isto pode resultar em um falso diagnóstico da doença ou um diagnóstico muito tardio, freqüentemente após a planta já ter morrido. O peritécio pode ser difícil de ser observado no campo porque muitas raízes que o contém perdem-se se perdem durante a amostragem do solo. Quando maduros, os peritécios se rompem, liberando os ascósporos no solo (Figuras 4 & 5).
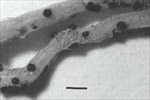
Figura 3 |

Figura 4 |

Figura 5 |
Biologia do patógeno
Monosporascus cannonballusé um fungo pirenomiceto (Ascomycota: Sordariales), embora a sua taxonômia exata provavelmente necessite ser re-examinada. O fungo é conhecido por formar um ascósporo largo (40-50 μm de diâmetro), esférico, com várias camadas na parede (Figuras 6 & 7), porém somente um ascósporo é formado por asco ao inv és de oito como normal (Figura 8). Os ascósporos são multinucleados, tendo geralmente oito núcleos, embora, ocasionalmente possam ter 16. Não há estágio anamórfico (assexual) conhecido. Quatro espécies deMonosporascusjá foram descritas, mas somente duas,M. cannonballuseM. eutypoidestêm sido envolvidas em doenças das cucurbitáceas. Ambas são patogênicas ao melão e foram diferenciadas originalmente, tendo por base o número de ascósporos por asco e se estes germinam prontamente ou não. Estudos baseados na similaridade da seqüência parcial de DNA, patogenicidade e outras características fenotípicas, sugerem que os fungos pertencem à mesma espécie. Dados recentes sobre o modo de germinação dos ascosporos e o número de tubos germinativos formados sugerem a manutenção deles como espécies diferentes. Porém, isolados deM. eutypoidessão dificeis de localizar, tornando a comparação dificil. ComoM. cannonballusé o nome original (holótipo), sendo o principal patógeno reportado nos declínios dos ramos no mundo, esta denominação foi mantida neste artigo.
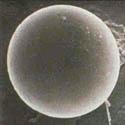
Figura 6 |
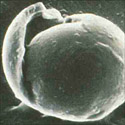
Figura 7 |
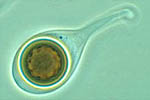
Figura 8 |
O fungo é homotálico (auto-fértil) e facilmente forma peritécios férteis no tecido da raiz do hospedeiro (Figuras 3,4)ein vitroem meio de cultura (Figura 5). Os ascósporos são espessos, com várias paredes (Figuras 6, 7 e 8) e extremamente resistentes à dessecação e outros fatores. A germinação dos ascósporos é rarain vitro, porém é promovidain situquando submetida à presença de exsudados da raiz de plântulas de melão do tipo muskmelon. A microflora do solo, mais precisamente os actinomicetos, são também importantes na germinação dos ascosporos no campo.
Monosporascus cannonballusestá adaptado a climas quentes e secos. O crescimento vegetativo ótimoin vitrositua-se na faixa de 25 a 35ºC, enquanto que os peritécios são formados mais rapidamente de 25 a 30ºC. O fungo pode sobreviver por vários dias sob temperatura de até 55ºC, mas é morto dentro de 90 minutos a 60ºC. O crescimento micelial ocorre em uma faixa de pH de 5 a 9, mas o ótimo é de 6 a 7 sendo completamente inibido em pH 4 e abaixo.Monosporascus cannonballustambém está aparentemente adaptado a solos ligeiramente ou moderadamente alcalinos e salinos. Este fungo cresce facilmente em vários meios de cultura padrões usados nos laboratórios (e.g. batata dextrose agar, V-8 agar e água agar) e forma peritécios negros e férteis dentro de 2 a 3 semanas. Os peritécios são prontamente visíveis contra o micélio cinza claro ou branco sujo.
Em cultivo (por example, BDA, suco V-8 e água-agar), colônias do tipo selvagem deMonosporascusapresentam coloração tipicamente esbranquiçadas ou cinza claro com numerosos peritécios escuros imersos no ágar. Sob algumas circunstâncias, as colônias podem produzir pigmentos, dando ao micélio uma coloração de amarelo-alaranjado à marrom-escuro. Colônias pigmentadas crescem lentamente, produzem poucos ou nenhum peritécio e são geralmente hipovirulentas. A morte de colônias ocorre frequentemente em cultivos muito pigmentados. Cinco hexaquetideos diferentes já foram identificados nas culturas pigmentadas. Pouco se sabe sobre o porque de algumas colônias desenvolverem esses pigmentos escuros, mas a dupla fita de RNA pode ter alguma função. A dupla fita de RNA também pode estar envolvida na redução da produção de peritécios e na hipovirulência.
Aparentemente, a variabilidade genética deM. cannonballusé pequena. Embora nenhuma análise detalhada de uma população extensa tenha sido feita, isolados selecionados deM. cannonballusde vários países, incluindo Estados Unidos, Japão e Espanha, revelaram-se idênticos em morfologia da colônia, número de ascósporos/asco (µm), virulência ao melão e seqüência de DNA ao longo das regiões dos espaços de transcrição (ITS 1 e 2) e gene 5,8S do rDNA, sugerindo que a maioria dos isolados são geneticamente muito semelhantes. Algumas diferenças parecem existir no que concerne a compatibilidade vegetativa entre isolados dos Estados Unidos e isoladas de outras regiões do mundo. Este aspecto não tem sido estudado em profundidade e pode adicionar informações valiosas no entendimento da genética deste fungo.
Em alguns casos, variações extremas na aparência da colônia, incluindo a formação de pigmentos de coloração amarela-escura, laranja ou marrom (castanha, pt) (Figura 14), reduzido crescimento vegetativo e perda da capacidade de produzir peritécios, como também perda da virulência e morte da colônia têm sido reportados. Isolados apresentando um ou mais destes fenótipos foram mostrados como portadores de RNAs (dsRNA) de dupla fita, aos quais foram atribuídos causando estes aberrantes fenótipos. Vários grupos distintos de dsRNA tem sido identificados. Isto tem sido explorado como um potencial biocontrole de podridão radicular de Monosporascus e declínio do ramo.

Figura 14 |
Ciclo da Doença
O ciclo da doença deM. cannonballusaparenta ser relativamente simples. A infecção das raízes pode ocorrer tanto do micélio que sobreviveu no solo ou restos culturais ou de ascósporos germinados(Figuras 9 A-B & 10). O fungo invade as raízes absorventes(Figuras 9 B-C & 11),coloniza o córtex e o xilema e mata a radícula.

Figura 10 |
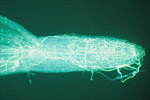
Figura 11 |
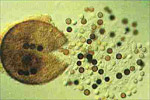
Figura 12 |
A infecção avança para a próxima raiz adjacente pela junção das raízes ou talvez por novas infecções. As raízes menores morrem enquanto as lesões são formadas predominantemente nas raízes maiores. O fungo continua a colonizar os tecidos das raízes e invade o xilema, induzindo a planta à formação de tiloses. Enquanto o fungo invade o xilema, torna-se sistêmico na planta e portanto não é um típico patógeno de murcha vascular comoFusarium oxysporumouVerticilliumspp. A infecção é favorecida pela alta temperatura do solo (25 to 35 C°). Nos climas em que ocorrem duas estações de cultivo (duas safras por ano) a doença é tipicamente mais severa nos cultivos tardios de verão ou início de outono do que nos de primavera ou inverno. Os peritécios são formados nas raízes mais abundantemente tarde no ciclo, mas podem ser formados durante todo o ciclo de vida. Quando maduros, os peritécios se rompem, liberando os ascósporos no solo (Figuras 4, 5, 9F). Várias centenas de ascósporos podem ser produzidas em um único peritécio (Figura 12) e um simples sistema radicular de uma planta de melão madura é capaz de conter 400 mil ou mais ascósporos.
Estresses externos, de origem biótica ou abótica, podem aumentar os sintomas da doença e acelerar a murcha e o colapso do ramo. Um aspecto que tem sido investigado a esse respeito é a carga de frutos. O colapso do ramo normalmente ocorre durante a maturação do fruto e vários estudos têm demonstrado que a remoção dos frutos em desenvolvimento nas plantas infectadas retardam a expressão dos sintomas e, em alguns casos, previne a murcha e a morte da planta.
Os sintomas na parte aérea envolvem um declínio gradual das folhas, começando tipicamente pelas folhas de dentro e progredindo para fora. Mais tarde no ciclo, muitas folhas estão mortas, expondo os frutos em desenvolvimento a uma intensa radiação solar e calor. A combinação de tiloses nos tecidos das raízes e a perda da maioria das raízes secundárias e terciárias provocam o colapso rápido dos ramos, freqüentemente parecendo como se eles entrassem em colapso da noite para o dia. Campos inteiros de plantas podem vir a entrar em colapso, resultando em perdas econômicas totais ou quase totais. Este colapso rápido sugere os nomes das doenças tais como “morte súbita” ou “murcha súbita”. Os frutos de plantas infectadas são de baixa qualidade devido ao reduzido tamanho e conteúdo de açúcar, ou podem apresentar-se queimados pelo sol ou com rachaduras.
Um protocolo baseado em PCR usando iniciadores especificos ITS foi desenvolvido para detecção rápida deM. Cannonballusem tecidos radiculares. Semelhantemente, um outro protocolo de PCR em tempo real foi desenvolvido baseado na região ITS 1 do DNA ribossômico. Esta última técnica tem sido usada associada a análises de imagens coloridas na avaliação de diferenças fenotipicas de reações de raizes de melão àM. Cannonballus.
Epidemiologia
Nenhum estágio aéreo da doença é conhecido e nenhum estágio assexual do fungo foi observado. Conseqüentemente, os ascósporos são considerados o inóculo primário e podem sobreviver no solo ou restos culturais até ao próximo plantio. Na ausência do hospedeiro, os ascósporos podem sobreviver por muitos anos em estado de dormência. O micélio em restos culturais infectados pode servir como fonte de inóculo, embora não se saiba quanto tempo o micélio sobrevive no solo. A doença é considerada monocíclica.
Os ascósporos podem atingir elevado número em áreas cultivadas sucessivamente com melão; porém, o limite mínimo para o desenvolvimento da doença não é conhecido. Severos níveis da doença têm ocorrido em campos contendo densidades de ascósporos que vão de um a dois ascósporos até 15 esporos por grama de solo seco. Nos poucos casos estudados, os ascósporos parecem estar uniformemente distribuídos no campo, com as mais elevadas concentrações na camada superior de 25 cm. Há evidências de que o fungo é capaz de colonizar e se reproduzir em raízes de outras plantas (monocotiledôneas e dicotiledôneas) sem causar doença visível, dispondo de um outro mecanismo de sobrevivência e reprodução. Ademais, ascósporos têm sido encontrado em solos não cultivados e em solos desertos e selvagens no Texas e Arizona nos Estados Unidos e no Brasil. Conseqüentemente,M. cannonballusé aparentemente um fungo nativo de solo e a epidemiologia desta doença pode ser mais complexa do que é atualmente entendida.
A dispersão deste patógeno pode ser feita por qualquer método que movimente o solo ou os restos culturais infectados e.g. cultivo, inundação, vento, erosão, etc. Dispersão pelo ar é improvável, face ao grande tamanho dos ascósporos e à falta de um estágio conidial conhecido. Não há evidência de que o patógeno seja transmitido pela semente nem sistêmico na planta. A colonização é aparentemente limitada às raízes. Os frutos e as folhas não são diretamente infectados, embora manifestem os sintomas relacionados com a infecção da raiz, estresse hídrico e declínio da planta.
Manejo da Doença (Meios de Luta, pt)
O controle (controlo, pt) da PRM/DR tem se revelado difícil. Presentemente, não há nenhum método disponível que seja tanto economicamente efetivo como persistente o qual possa promover um controle adequado da doença, entretanto, pesquisas usando diferentes estratégias estão em andamento em vários laboratórios. Os fatores que contribuem para as dificuldades no controle da PRM/DR incluem:
- cultivo intensivo e sucessivo de melão, promovendo a acumulação de inóculo;
- presença de muitos ascósporos de parede espessa que podem residir no solo por anos e os quais são aparentemente tolerantes à dessecação e a produtos químicos;
- a dificuldade geral em se aplicar e incorporar pesticidas no solo;
- a capacidade de tamponamento do solo e da rizosfera das plantas;
- a provável longa lista de hospedeiros do fungo e a sua habilidade de colonizar e reproduzir-se em várias plantas monocotiledôneas e dicotiledôneas;
- práticas culturais como a cobertura do solo com filme plástico e irrigação por gotejamento subterrâneo que criam um ambiente favorável no solo para infecções e sobrevivência do fungo;
- práticas culturais que resultam em um desenvolvimento pobre e incipiente do sistema radicular; e
- a inexistência de genótipos de melão que sejam resistentes ou altamente tolerantes à infecção e à doença, respectivamente.
Apesar destes obstáculos, algum progresso está sendo feito no manejo (meios de luta, pt) desta doença. Um enfoque integrado de manejo (meio de luta, pt) da PRM/DR pode vir a ser a melhor estratégia. A integração aumenta as possibilidades de desenvolvimento de programas efetivos de manejo (meios de luta, pt) pela combinação parcial de métodos, reduzindo as possibilidades de efeitos colaterais negativos e promovendo a flexibilidade em se adaptar os programas de controle a diferentes situações agrícolas.
Tratamento do Solo.A técnica mais efetiva até agora tem sido a fumigação do solo em pré-plantio com brometo de metila (metilo, pt) (Figura 13), cloropicrina, 1,3 dicloropropeno ou metam sódio (Vapam ™). Porém, a esperada suspensão do comércio de brometo de metila e a crescente restrição ao uso de fumigantes em geral torna esta estratégia dif ícil . Outros compostos têm sido aplicados experimentalmente via irrigação por gotejamento e têm mostrado vários níveis de controle. A aplicação experimental de Fluazinam, (Frowncide™: ISK, Japão) via irrigação por gotejamento durante o cultivo controlou efetivamente a doença em Israel em plantio de primavera, mas foi menos efetiva no plantio de verão tardio; entretanto, fluazinam não é registrado para o controle deM. cannonballusem curcubitáceas nos Estados Unidos. Fludioxinil (Cannonball ™, Syngenta) é registrado para controle deM. cannonballusem melão e melancia quando aplicado via irrigação por gotejamento. Uma estratégia em múltiplas fases consistindo de uma fumigação do solo em pré-plantio para reduzir o inóculo residente no solo, uma aplicação em pós-plantio de fungicida para inibir a colonização das raízes durante o ciclo e um cultivo pós-colheita das plantas, seguida de uma imediata aplicação pós-colheita de metam sodium (Vapam ™) para prevenir a produção de ascosporos, tem sido desenvolvido para o controle da PRM/DR na Califórnia.

Figura 13 |
Solarização do solo.Estudos conduzidos nos Estados Unidos e em Israel usando solarização convencional do solo revelaram-se ineficientes no controle da PRM/DR, provavelmente devido à capacidade do fungo em crescer a altas temperaturas. Porém, um método modificado de solarização em plantas envasadas e a combinação desta com níveis reduzidos de fumigação têm demonstrado um bom potencial para o controle da PRM/DR, assim como para o controle de outras doenças causadas por patógenos de solo em Israel.
Resistência genética.Como a maioria das doenças causadas por patógenos de solo, a resistência genética a PRM/DR é o método preferencial para controle, porém, uma boa fonte de resistência aM. cannonballusainda não foi identificada. Vários laboratórios estão procurando ativamente fontes de resistência e poucas linhas de melão têm sido identificadas exibindo tolerância à PRM/DR, incluindo vários acessos deC. melosubsp.agrestise de vários tipos de melões Galia e Ananas. Até o presente, nenhum tipo de melão de exportação ocidental tem demonstrado qualquer nível de resistência ou tolerância aM. cannonballus. Pesquisas têm demonstrado a importância de sistemas radiculares bem desenvolvidos e vigorosos na resistência ao declínio e a arquitetura da raiz vem sendo avaliada como uma característica fenótipica de tolerância e ou resistência. Acredita-se que a estrutura da raiz é o principal fator na enxertia de melões susceptíveis sobre porta-enxertos deCucurbitasp. e cabaça para o controle de PRM/DR (vide item enxertia, abaixo).
Enxertia.Outras tentativas de controle da PRM/DR incluem a enxertia de melões susceptíveis (muskmelon e melancia) em porta-enxertos deCucurbitaspp. ouLagenariaspp. (cabaça). Esta prática é comumente usada na Ásia e no Mediterrâneo para o controle de várias doenças causadas por patógenos de solo, principalmente a murcha (murchidão, pt) de Fusário (fusariose, pt), mas vem crescendo o uso no manejo de PRM/DR. Geralmente, há uma boa compatibilidade enxerto/porta-enxerto entre muitas espécies de cucurbitáceas e o sistema radicular extenso e largo destas abóboras e cabaças as permitem sobreviver às infecções durante todo o ciclo. Porém, o uso destes porta-enxertos devem ser enfocados com certa precaução, uma vez que eles são susceptíveis à infecção porM. cannonballuse, conseqüentemente, podem contribuir para o aumento do inóculo no solo, ainda que, esses porta-enxertos normalmente não desenvolvem grandes quantidades de peritécios em suas raizes.
Controle biológico(Luta Biológica, pt). O uso de isolados deM. cannonballushipovirulentos foi investigado como um agente de controle biológico (luta biológica, pt) da PRM/DR. Isolados infectados com um ou mais RNAs de dupla fita (ds) muitas vezes resultam em culturas com virulência grandemente reduzida (hipovirulência) (Figura 14). Estes dsRNAs podem ser transmitidos para isolados virulentos normais e selvagens através de anastomoses entre as hifas (fusão), tornando-os hipovirulentos. A “cura” subseqüente dos isolados infectados pelo extensivo crescimento sob alta temperatura restabelece a patogenicidade original. Até agora, a hipovirulência transmissível somente tem mostrado potencial de controle da doença em experimentos em casa-de-vegetação (estufa, pt) (Figura 15). Além disso, o tratamento de sementes de melão com jasmonato de metil, um conhecido indutor de mecanismos de defesa da planta a patógenos, reduziu a severidade de PRM/DR, sob condições experimentais e oferece uma estratégia potencial de controle no futuro.

Figura 14 |

Figura 15 |
Importância
A podridão radicular de Monosporascus e declínio dos ramos é uma doença emergente no mundo todo, que vem, recentemente, ganhando atenção entre os fitopatologistas. Este é o principal patógeno do declínio dos ramos do melão em plantio tardio de verão na maioria das áreas cultivadas com meloeiro no mundo. O agente causal,Monosporascus cannonballusfoi descrito como um gêneroet species novuspor Pollack e Uecker em 1974, baseado em espécimes obtidos de raízes de melão do tipo muskmelon necrosadas procedentes do Arizona. Nenhum ensaio de patogenicidade foi conduzido naquela ocasião. O primeiro relato de confirmação de patogenicidade foi de Israel em 1983, onde foi apresentado como agente causal de um colapso do meloeiro maduro, embora o patógeno fosse identificado comoM. eutypoides. Um relato anterior do Japão indicava que este fungo era não patogênico. A patogenicidade de isolados dos Estados Unidos foi relatada pela primeira vez em 1991, por Mertely et al. no Texas, e a doença foi chamada de podridão radicular de Monosporascus e declínio dos ramos (PRM/DR). Até 1997, a doença tinha sido relatada no Texas, Arizona e Califórnia nos Estados Unidos e em outros 13 países. Desde então, a doença foi reportada em quatro outros países, aumentando o número total de paises em que a doença ocorre em 2009 para dezoito (Figura 16, Tabela 1). É altamente provável que PRM/DR seja detectada em outros países em um futuro próximo.
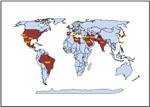
Figura 16 |
TABELA 1. Países onde já foram reportadosMonosporascus cannonballusouM. Eutypoides |
| País |
Ano reportado |
Referência |
| EUA (AZ) |
1974 |
Pollack, F.G. & Uecker, F.A. Mycology 66:346 |
| EUA (TX) |
1990 |
Mertely, J.C., et al. Plant Dis. 75:1133 |
| EUA (CA) |
1995 |
Bruton, B.D., et al. Plant Dis. 79:754 |
| Líbia |
1978 |
Hawksworth, D.L. & Ciccarone, A. Mycopathologia 66:147 |
| India |
1978 |
Hawksworth, D.L. & Ciccarone, A. Mycopathologia 66:147 |
| Japão |
1979 |
Watanabe, T. Trans. Mycol. Soc. Japan 20:312; |
| |
1985 |
Uematsu, S., et al. Ann. Phytopathol Soc. Japan 51:272. |
| Israel |
1983 |
Reuveni, R., et al., Trans. Br. Mycol. Soc. 80:354 |
| Espanha |
1990 |
Lobo-Ruano, M. Bol. San. Veg. Plagas 16:701 |
| Tunisia |
1994 |
Martyn, R.D., et al. Plant Dis. 78:1220 |
| Coreia |
1994 |
Park, K.S., et al. Korean J. Plant Pathol. 10:175 |
| Taiwan (R.O.C.) |
1995 |
Tsay, J-G & Tung, B-K. Plant Pathol. Bull.4:25 |
| México |
1996 |
Martyn, R.D., et al. Plant Dis. 80:1430 |
| Arábia Saudita |
1997 |
Karlatti, R.S., et al. Plant Dis. 81:1215 |
| Guatemala |
1997 |
Bruton, B.D. & Miller, M.E. Plant Dis. 81:694 |
| Honduras |
1997 |
Bruton, B.D. & Miller, M.E. Plant Dis. 81:696 |
| Itália |
1999 |
Gennari, S., et al. Infomatore Fitopatologica 49:38 |
| Brasil |
2004 |
Sales, Jr., R., et al. Plant Dis. 88:84 |
| Irã |
2008 |
Sarpeleh, A. Aust. Plant Dis. Notes 3:162 |
| Iraque |
? |
|
| Paquistão |
? |
|
As perdas causadas pela PRM/DR podem ser muito grandes. O patógeno parece estar disperso uniformemente por todos os campos, causando infecção uniforme e extensiva. O dano é feito ao sistema radicular por todo o ciclo da cultura e, caracteristicamente, dentro de uma ou duas semanas antes da colheita, os ramos murcham ou entram rapidamente e completamente em colapso. Este fato resulta em plantas cujos frutos são expostos diretamente aos raios solares e comumente racham e queimam. Além disso, uma vez que a maioria do teor de açúcar é deslocada para frutos nas últimas semanas de crescimento, os frutos de ramos infectados são de baixo teor de açúcar, de qualidade e tamanho inferior. Em muitos casos, perda econômica total pode acontecer.
A podridão radicular de Monosporascus e declínio dos ramos é um exemplo de uma doença de declínio dos ramos do meloeiro. O declínio dos ramos é um termo geral utilizado para descrever um grupo de doenças recalcitrantes com sintomas semelhantes, mas supostamente de diferentes agentes causais. Os sintomas gerais deste grupo de doenças incluem o amarelecimento e morte das folhas do topo e um declínio gradativo do ramo quando a planta aproxima-se da maturidade. Um rápido colapso do ramo ocorre tarde no ciclo, tipicamente próximo à colheita. O efeito primário é a destruição das raízes, restringindo a absorção e transporte de água na fase final do ciclo, quando a planta está experimentando uma elevada demanda devido às altas taxas de transpiração via estômatos e transporte de água para os frutos , resultando em ramos que entram em colapso da noite para o dia. O declínio do ramo vem crescendo de uma forma mais proeminente nos últimos 25 anos.
Uma questão comum é: “Por que esta doença vem se tornando tão proeminente na última década?”. Não há resposta definitiva para esta questão, mas há vários fatores que provavelmente têm contribuído para isto. Primeiro, ela provavelmente não deveria ser uma nova doença nos anos 80’s, mas já estava presente em vários locais, mas ou não era identificada ou era identificada de uma forma errada. Uma vez relatado como um patógeno do meloeiro em Israel, outros laboratórios talvez foram levados a olhar com mais cuidado. Ademais, existem várias condições e práticas culturais em melão que têm mudado radicalmente nos últimos 25 anos que são coincidentes com o crescimento das doenças de declínio do ramo: a) a mudança virtualmente completa de meloeiros de polinização aberta e melancias para híbridos, resultando em plantas com precocidade e frutificação mais concentrada; b) a mudança de plantio direto da semente para o transplante de mudas; e c) a mudança de cultivo de plantas em solo desnudo com irrigação em sulco ou por aspersão para o uso de cobertura plástica e irrigação por gotejamento. Essas duas últimas práticas resultam em plantas com sistemas radiculares pouco desenvolvidos e superficiais que tendem a crescer paralelamente abaixo do plástico em vez de penetrar mais profundamente no perfil do solo. E, finalmente, com grandes investimentos e custos de produção elevados, muitos produtores têm diminuído os seus esquemas de rotação de cultura e estão reusando seus campos muito cedo ou, em alguns casos, continuamente por dois ou mais sucessivos cultivos de melão. Esta prática soma-se significativamente para o aumento do inóculo no solo.
Todos esses fatores podem afetar as condições gerais da planta e predispô-la à infecção. Um outro fator a ser considerado é que ao longo dos últimos 25 anos, mais e mais áreas não cultivadas têm sido abertas e plantadas com melancia e melão. Há alguma evidência queM. cannonballusé um patógeno nativo e indígena. O plantio de hospedeiros altamente susceptíveis, como o melão, deve ter selecionado ou atraído o fungo e promovido seu rápido crescimento. Desde que novas variedades de melão e práticas culturais são constantemente e rapidamente adotadas pelos produtores pelo mundo afora, é possível que a seleção para o patógeno também ocorreu rapidamente. Enquanto não há dados seguros que suportem esta hipótese, justifica-se alguma consideração e testagem.
M. cannonballusé um patógeno devastador do meloeiro onde quer que ocorra, mas não pode explicar ou ser considerado como responsável por todos os csos de declínio de ramos e colapsos observados pelo mundo afora. Em casos ondeM. cannonballusnão foi encontrado, outros organismos têm sido envolvidos na doença. A maioria desses casos refere-se a fungos, porém viroses, bacterias e até mesmo herbicidas também têm sido envolvidos. Em outros casos, o agente causal definitivo não foi descrito. O principal contribuidor para a síndrome do declínio é o pobre desenvolvimento do sistema radicular. Mudas transplantadas desenvolvidas em células pequenas tipicamente não desenvolvem raizes pivotantes fortes (Figura 17). À medida em que essas raizes se alongam e alcançam o fundo da célula, elas se curvam em torno das extremidades, resultando em pivotantes que param de crescer ou continuam crescendo em círculo em torno das bordas da célula. Quando transplantadas para o campo, a raiz pivotante não se recupera e nem cresçe para baixo no perfil do solo, mas em vez disso produz uma planta com proliferação de raizes laterais que crescem horizontalmente ao longo do canteiro de transplantio seguindo o curso de água, mas sem uma raiz pivotante típica (Figura 17). Ao final do ciclo, quando a demanda por água é elevada, o sistema radicular comprometido sofre para manter esta demanda. Neste estágio, não carece muito de estresse adicional para provocar o colapso. Práticas culturais que melhorem o desenvolvimento das raiz podem ajudar na mitigação de muitos dos sintomas de delínio de ramos no mundo. Alongando o container de transplante, tal como pelo uso de tubetes (Cone-tainers™), (Figura 18), comumente usados para mudas de pinheiro e de outras árvores, permitirá o desenvolvimento mais completo da raiz (Figura 19). Ademais, o uso de técnicas melhoradas de irrigação tais como a irrigação com duas fitas gotejadoras enterradas a aproximadamente 15 a 20 cm abaixo da superficie do solo, em cada um dos lados das plantas coloca a água mais profundamente no solo e fora das camas de plantio, forçando as raizes a explorar maior área do perfil do solo, resultando ultimamente em um sistema radicular mais vigoroso que pode suportar a demanda dos ramos e frutos no final do ciclo e resistirem pequenos estresses (Figura 20). O tratamento de soluções nutritivas com um ou mais fungos micorrízicos antes da semeadura também pode melhorar o desenvolvimento das raizes. O plantio direto, entretanto, ainda produz normalmente as melhores raizes e ramos.

Figura 17 |

Figura 18 |

Figura 19 |

Figura 20 |
Referências Selecionadas
Batten, J. S., K-B. Scholthof, B.R. Lovic, M.E. Miller, and R.D. Martyn. 2000. Potential for biocontrol of Podridão radicular de Monosporascus e declínio dos ramos do meloeiro / vine decline under greenhouse conditions using hypovirulent isolates ofMonosporascus cannonballus. European Journal of Plant Pathology 106:639-649.
Cohen, R., S. Pivonia, Y. Burger, M. Edelstein, A. Gamliel, and J. Katan, J. 2000. Toward integrated management of Monosporascus wilt of melons in Israel.Plant Dis. 84:496-505.
Egel, D.S., R. Martyn, and C. Gunter. 2008. Planting method, plastic mulch, and fumigation influence growth, yield, and root structure of watermelon. HortScience 43:1410-1414.
Miller, M.E., R.D. Martyn, and B.D. Bruton. 2000. Muskmelon growth and yield in response to fumigation. Acta Horticulturae 510:179-185.
Martyn, R.D. 2007. Late-season vine declines of melons: Pathological, cultural or both? Acta Horticulturae 731:345-356.
Martyn, R. D. and M. E. Miller. 1996. Monosporascus root rot/vine decline: An emerging disease of melons worldwide. Plant Disease 80:716-725.
Martyn, R. D. and M. E. Miller. 1996. Monosporascus root rot/vine decline of muskmelon and watermelon. Pages 18-19.in: T. A. Zitter, D. A. Hopkins, and C. E. Thomas (eds.), Compendium of Cucurbit Diseases, APS Press, St. Paul, MN.
Dias, R., B. Picó, A. Espinos, and F. Nuez. 2004. Resistance to melon vine decline derived fromCucumis melossp.agrestis: Genetic analysis of root structure and root response. Plant Breeding 123:66-72.
Pollack, F. G., and F. A. Uecker. 1974.Monosporascus cannonballus, an unusual Ascomycete in cantaloupe roots. Mycologia 66:346-349.
Radewald, K.C., D.M. Ferrin, and M.E. Stanghellini. 2004. Sanitation practices that inhibit reproduction ofMonosporascus cannonballusin melon roots left in the field after crop termination. Plant Pathology 53:660-668.
Stanghellini, M. E., D.H. Kim, and S.L. Rasmussen. 1996. Ascospores ofMonosporascus cannonballus: Germination and distribution in cultivated and desert soils in Arizona. Phytopathology 86:509-514.
Waugh, M.M., D.M. Ferrin, and M.E. Stanghellini. 2005. Colonization of cantaloupe roots byMonosporascus cannonballus. Mycological Research 109:1297-1301.