Mancha Anelar (Anéis Necróticos, pt) do Mamoeiro
Papaya ringspot virus
Mamoeiro e Cucurbitáceas
Sintomas e Sinais
Papaya ringspot virus infeta sistemicamente mamoeiro e cucurbitáceas. Os sintomas em mamoeiro são de alguma forma semelhantes àqueles produzidos em cucurbitáceas. Em mamoeiro, as folhas apresentam mosaico proeminente e clorose, com estrias oleosas nos pecíolos e na parte superior do tronco. Sintomas severos, normalmente, incluem distorção das folhas jovens que podem resultar em deformações em formato de cordões de sapato que se assemelham a danos ocasionados por ácaros. As plantas que são infetadas quando jovens permanecem pouco desenvolvidas e não produzem frutos de forma econômica. Frutos de plantas infetadas podem apresentar saliências semelhantes às ocasionadas por deficiência de boro e sempre apresentam manchas anelares, sintomas típicos da doença que constituem a base do seu nome comum (Figura 1). Foi demonstrado que uma estirpe severa de PRSV isolada em Taiwan pode ocasionar mosaico e clorose, acompanhado de necrose sistêmica e murcha.

Figura 1
Nas cucurbitáceas, as folhas apresentam intenso mosaico, com estreitamento da área foliar. Casos severos podem resultar em deformações foliares, com aparência de cordões de sapato semelhantes aos sintomas observados em mamoeiro. As plantas que são infetadas quando jovens não se desenvolvem nem produzem frutos. Plantas infetadas quando adultas chegam a produzir frutos, os quais apresentam mudanças na coloração e deformações do formato. Por exemplo, uma abobora amarela de pescoço pode apresentar várias áreas de verde descolorido com protuberâncias (Figura 2).

Figura 2
Observadores experientes podem detectar sintomas em mamoeiro em estágio inicial antes do desenvolvimento de mosaico intenso e clorose. Os primeiros sintomas aparecem na forma de estrias oleosas nas folhas jovens, as quais apresentam clareamento ao longo das veias que lhe dão a aparência de manchas. Estes primeiros sintomas devem ser usados para detectar plantas com início de infeção quando "rouging" (erradicação de plantas infetadas) é usado como forma de controle da doença.
Biologia do Patógeno
TAs propriedades gerais do PRSV são similares às da maioria dos vírus do gênero Potyvirus da família Potyviridae. Os afídeos transmitem o vírus para o mamoeiro e para as cucurbitáceas de forma não persistente, em outras palavras, o vírus é adquirido e transmitido por seu vetor em curto período de tempo que pode ser medido em segundos ou minutos. O vírus não se replica no vetor. As inclusões amorfas (IA) formadas de proteínas produzidas pelo gene do vírus (HC-Pro) constituem um componente proteico auxiliar necessário para o sucesso da transmissão por afídeos. O PRSV é, também, facilmente transmitido por inoculação mecânica, mas não existe nenhuma confirmação científica da transmissão do PRSV por sementes.
A partícula do vírus ou o virião consiste de um núcleo-capsídeo, em forma de bastonete filamentoso e flexuoso, medindo aproximadamente 760-800 x 12 nm (Figura 3). O peso molecular das partículas de vírus possui 94,5% de proteína e 5,5% de ácido nucléico, e as partículas não possuem membrana externa ou envelope. A densidade flutuante das partículas de vírus purificadas é de 1.32 g cm-3 em cloreto de césio. O ponto de inativação térmica (PIT) do PRSV é de 54-60oC e sua longevidade in vitro (LIV) é de aproximadamente 0,3 dias. A primeira seqüência completa do genoma do PRSV foi obtida de um isolado do vírus obtido no Havaí (PRSV-HA). Semelhante a outros potyvirus, o genoma do PRSV é constituído por uma molécula de RNA linear, de hélice simples e senso positivo, com aproximadamente 10.326 nucleotídeos, excluindo a seqüência de poli-A presente na sua extremidade 3'. Típico dos potyvirus, o genoma do PRSV produz uma única longa proteína (no caso do PRSV, 3.344 aminoácidos), a qual é subseqüentemente clivada em proteínas menores com várias funções. As proteínas clivadas são: P1, HC-Pro, P3, CI, 6K, NIa-Pro, NIb e CP (Figura 4). As diferentes proteínas funcionais são formadas através de uma série de clivagens em pontos específicos realizadas por três proteases produzidas pelo vírus, P1, HC-Pro e NIa. As possíveis funções das proteínas produzidas pelo genoma do PRSV foram deduzidas a partir de estudos com vírus do gênero Potyvirus e estão listadas na Figura 4.
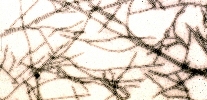
Figura 3 |
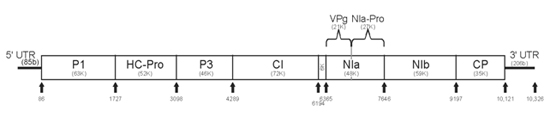
Figura 4 |
| Genes |
Tamanho (MMr) |
Funções |
| P1 |
63K |
Protease |
|
|
Movimento Célula – Célula |
| HC-Pro |
52K |
Transmissão por Vetor |
|
|
Proteinase |
|
|
Patogenicidade |
|
|
Supressor do silenciamento de RNA |
|
|
Movimento Célula – Célula |
| P3 |
46K |
Não conhecido, mas possível função na replicação |
| 6K1 |
6K |
Não conhecido, mas possível função na replicação: |
|
|
Replicação do RNA |
|
|
Regulação; inibição de translocação nuclear de NIa |
|
|
Replicação |
| CI |
72K |
Replicação do Genoma (helicase do RNA) |
|
|
Ligação com membranas |
|
|
Estimulação da atividade ATPase do Acido nucléico |
|
|
Movimento Célula – Célula |
| 6K2 |
6K |
Mesmo da 6K1 |
| NIa-VPg |
21K |
Replicação do genoma (Primer para iniciação da síntese do RNA) |
| NIa-Pro |
27K |
Principal protease |
| NIb |
59K |
Replicação do genoma (RdRp- RNA- dependente de RNA polimerase) |
| CP |
35K |
Encapsidação do RNA |
|
|
Transmissão por vetor |
|
|
Patogenicidade |
|
|
Movimento Célula - Célula |
Figura 4. Organização do genoma do PRSV, genes e suas possíveis funções. (Cortesia de D. Gonsalves, cópia-livre)
Com base na sua gama de hospedeiros o PRSV está dividido em dois grandes biótipos ou em duas estirpes. O tipo PRSV-W que infeta cucurbitáceas, mas não infeta mamoeiro, enquanto o tipo PRSV-P infeta mamoeiro e algumas espécies de cucurbitáceas. Este agrupamento foi realizado para esclarecer a história da literatura, bem como proporcionar uma melhor indicação do ciclo de vida e o impacto na epidemiologia da doença. Anterior a 1984, quando os biótipos P e W eram separados, as referências bibliográficas referiam-se à doença do mamoeiro ocasionada pelo PRSV-P conhecida hoje como mancha anelar (anéis necróticos, pt) do mamoeiro sendo que as publicações mais recentes demonstraram que o vírus que infeta mamoeiro também infeta cucurbitáceas. Paralelamente, o vírus que ocasionava doença em cucurbitáceas, hoje conhecido como PRSV-W era designado por Watermelon mosaic virus-1 (WMV-1) para distinguir de outra doença ocasionada por Watermelon mosaic virus-2 (WMV-2). Não existia nenhuma conexão obvia entre PRSV em mamoeiro e WMV-1 em cucurbitáceas, uma vez que WMV-1 não infeta mamoeiro. Estudos sorológicos posteriores, contudo, demonstraram que PRSV e WMV-1 eram sorologicamente indistinguíveis e, desta forma, foi sugerido que eles eram biótipos de um mesmo vírus, Papaya ringspot virus. Este agrupamento funcional serviu para proporcionar à comunidade científica uma clara e simples forma de distinguir os dois biótipos.
O PRSV, código de vírus: 00.057.0.01.045 é uma espécie do gênero Potyvirus (00.057.0.01) aprovada pelo ICTV, na família Potyviridae (00.057). Um link para este vírus é: ICTVdB Index of Viruses.
Ciclo da Doença e Epidemiologia
O PRSV é transmitido por afídeos de forma não persistente e não se multiplica no vetor. O ciclo da doença pode ter início com afídeos se alimentando em plantas de mamoeiro infetadas por curto período de apenas 15 segundos e subseqüentemente se alimentando em mamoeiro sadio. Não há período de incubação. Como o vírus não persiste no vetor, a transmissão para outra planta deve ocorrer rapidamente. Para um curto vídeo clipe sobre esse tipo de transmissão veja o Video clip - Cucumber mosaic virus. Os biótipos P e W de PRSV podem ser encontrados em qualquer parte onde seus hospedeiros são cultivados. Por exemplo, o biótipo W é extensivamente encontrado em áreas aonde existe pouco mamoeiro, como no interior dos Estados Unidos. De fato, o PRSV-W é um dos quatro principais vírus (PRSV-W, WMV-2, Zucchini yellow mosaic virus, e Cucumber mosaic virus) que ocasionam danos crônicos em cucurbitáceas no sudoeste dos Estados Unidos. Contudo, o PRSV-W pode ser também encontrado causando doença em cucurbitáceas em regiões tropicais e subtropicais. De outra parte, o PRSV-P é encontrado somente em áreas tropicais e subtropicais onde o mamoeiro é normalmente cultivado..
Nas regiões tropicais e subtropicais, onde os dois biótipos e seus hospedeiros estão presentes, o PRSV-P efetivamente completa seu ciclo em mamoeiro enquanto que PRSV-W completa seu ciclo em cucurbitáceas. Em outras palavras, nestas regiões as cucurbitáceas não servem como hospedeiro alternativo para PRSV-P.
Observações sobre o PRSV na Austrália proporcionam uma indicação sobre a origem dos biótipos de PRSV. Até 1991, somente o PRSV-W era constatado na Austrália. Contudo, em 1991, o PRSV-P foi detectado lá infetando mamoeiro. Analises das seqüências do novo PRSV-P bem como do tipo PRSV-W na Austrália demonstraram que eles eram estreitamente relacionados. Desta forma, assumiu-se que o aparecimento do PRSV-P na Austrália foi por conta de mutações estabelecidas em PRSV-W que proporcionou a capacidade de infetar o mamoeiro. Estas observações sugerem que o PRSV-P se originou do PRSV-W. De fato, tem sido demonstrado experimentalmente que existem apenas alguns pontos de mutação que distinguem os biótipos PRSV-P e PRSV-W.
Manejo da Doença (Meios de Luta, pt)
TAs diferentes opções para o manejo (meios de luta, pt) de doenças ocasionadas por vírus são controle do vetor, plantio em aéreas livres de vírus, "rouging" (erradicação de plantas infetadas), proteção cruzada e uso de variedades resistentes. O controle do vetor para o manejo do PRSV não é uma opção econômica por várias razões. O PRSV é transmitido de forma não persistente e o vetor adquire e transmite o vírus dentro de segundos ou minutos. Desta forma, os afídeos chegando dentro das áreas pulverizadas para o controle do vetor podem adquirir e rapidamente transmitir o vírus, sem que os inseticidas promovam sua morte em tempo suficiente para conter a transmissão. De acordo com o que já foi mencionado, os hospedeiros do PRSV economicamente importantes incluem o mamoeiro e as cucurbitáceas, duas culturas com características culturais diferentes. O mamoeiro é uma planta herbácea tropical perene enquanto que as cucurbitáceas são culturas olerícolas que se desenvolvem em períodos de apenas alguns meses.
Mamoeiro. O mamoeiro não é o hospedeiro preferido pelos afídeos vetores do PRSV. O manejo da doença através do controle do vetor dentro de um pomar de mamoeiro é muito difícil, uma vez que os afídeos visitam e provam o mamoeiro, mas não colonizam as plantas dentro dos pomares.
Resistência e Tolerância Clássica em Mamoeiro. Resistência natural ao PRSV não tem sido identificada em Carica papaya. Existe resistência ao PRSV em espécies do gênero Vasconcellea, as quais são relacionadas a C. papaya. Contudo, os cruzamentos entre C. papaya e Vasconcellea spp. não são férteis. Esforços têm sido feitos para transferir o(s) gene(s) putativo(s) de resistência, através de cruzamentos entre C. papaya e Vasconcellea spp, seguidos de recuperação de embriões e subseqüente retro-cruzamento com C. papaya, mas até agora nenhum tipo ou híbrido não foi comercialmente desenvolvido. A incorporação de tolerância a mancha anelar (Papaya Ringspot, PRS) em C. papaya tem sido realizada com mais sucesso. Algumas linhagens tolerantes a PRS têm sido comercializadas nas Filipinas e são vendidas em Taiwan, e linhagens tolerantes têm sido liberadas na Florida e na Tailândia; estas linhagens apresentam somente sintomas leves quando infetadas. No entanto, o PRSV pode ser disseminado através de pomares de linhagens tolerantes, uma vez que elas não são resistentes ao vírus. Quando estas linhagens tolerantes são infetadas com PRSV, elas ainda são capazes de apresentar boa produção. No entanto, a qualidade dos frutos das linhagens tolerantes infetadas é geralmente marginal o que as conduzem a não serem largamente cultivadas.
Proteção Cruzada. Proteção cruzada é um fenômeno através do qual, plantas que são sistemicamente infetadas com uma estirpe fraca de um vírus são protegidas contra os efeitos da infeção de uma estirpe mais severa ou mais virulenta do vírus. Nos anos de 1980s, a proteção cruzada foi praticada extensivamente com sucesso em Taiwan e de forma mais limitada no Havaí. Em ambos os locais, a mesma estirpe fraca foi usada, a qual foi desenvolvida através da seleção de mutantes fracos resultantes do tratamento com ácido nitroso de extratos de tecidos de folhas infetadas com a estirpe severa de PRSV isolada no Havaí. A estirpe mutante ocasionava sintomas fracos em mamoeiro e em cucurbitáceas, e apresentava boa proteção contra as estirpes severas de PRSV do Havaí. No entanto, a primeira tentativa do uso desta estirpe fraca para proteção cruzada em larga escala foi em Taiwan, onde o PRSV era largamente distribuído ocasionando sérios danos. As etapas gerais para o uso de proteção cruzada em mamoeiro são: produção do inóculo, que consiste em infetar
Cucumis metuliferus com a estirpe fraca de PRSV; pulverização de mudas de mamoeiro em casa de vegetação ou telados, com extratos de plantas de
C. metuliferus infetadas; e plantio das mudas no campo 3-4 semanas após o estabelecimento do vírus. Estas plantas subseqüentemente estariam protegidas contra os danos ocasionados pelas estirpes severas do vírus. A proteção cruzada foi praticada em larga escala em Taiwan por vários anos, mas a prática foi abandonada por várias razões. A logística de produzir a estirpe fraca e a subseqüente garantia do suprimento de mudas de mamoeiro inoculadas com a estirpe fraca promoveu a inclusão de uma etapa adicional na produção de mamoeiro. A inclusão desta etapa adicional teria valido a pena, mas os resultados da sua aplicação em larga escala em Taiwan mostraram que a estirpe fraca não protegia adequadamente contra as estirpes de PRSV predominantes em Taiwan, como protegia contra a estirpe do Havaí. Após algum tempo, os produtores não estavam mais entusiasmados em continuar com a prática de manejo da proteção cruzada em Taiwan.
No Havaí, a proteção cruzada funcionou muito bem em experimentos limitados de campo na ilha de Oahu onde a PRS era bastante severa. Até mesmo no Havaí, contudo, a prática não foi adequadamente comercializada em razão de a estirpe fraca ocasionar sintomas quase que severos em alguns cultivares como Sunrise, e em razão da logística para produção de inóculo, da infeção uniforme das plantas com a estirpe fraca e da entrega de plantas infetadas com estirpe fraca aos produtores não funcionaram economicamente.
Resistência em mamoeiro geneticamente modificado. Mamoeiro geneticamente modificado (GM) foi produzido e comercializado no Havaí para controlar a PRS até o ano de 1998. Esta foi a primeira fruteira a ser modificada por engenharia genética e comercializada. O que se segue são conhecimentos básicos sobre a história do desenvolvimento de plantas de mamoeiro geneticamente modificadas (GM) no Havaí.
O estado do Havaí inclui sete ilhas habitadas (Havaí, Maui, Oahu, Kauai, Molokai, Lanai e Niihau) isoladas por milhas de oceanos. É, portanto, protegido do influxo continuo de PRSV de outras regiões geográficas. O PRSV foi descoberto em 1940, na ilha de Oahu, onde a indústria de mamão do Havaí está localizada. Nos anos de 1950s, o PRSV ocasionou danos severos nos pomares de mamoeiro no Oahu, e então a produção de mamão foi deslocada para o distrito de Puna na ilha do Havaí no começo dos anos 1960s. Em Puna, a indústria contou com a satisfação de vários anos de produção de mamão na ausência de PRSV. Contudo, no final da década de 1960, o PRSV foi detectado e se estabeleceu em Hilo na ilha de Havaí. Outros fatores adicionais ao isolamento geográfico desempenharam importantes papeis em manter o PRSV fora de Puna, uma vez que Hilo era somente 19 milhas distante. Os outros fatores incluíram inspeções constantes e "rouging" erradicação de plantas de mamoeiro com PRS em Hilo, atividade que ajudou a manter o baixo nível de incidência do PRSV na área de Hilo; quarentena no movimento de entrada de mudas de mamoeiro em Puna; e a inspeção para PRS no distrito de Puna, onde nos anos de 1970s, 95% do mamão do Havaí eram produzidos. Portanto, uma combinação de medidas de exclusão, isolamento geográfico, prática do rouging (erradicação), uso de quarentena para impedir que mudas infetadas fossem transportadas para Puna, e constantes esforços para deter e eliminar plantas infetadas, todos contribuíram para manter o distrito de Puna livre de PRSV.
No entanto em 1992, o PRSV foi detectado em Puna e o cenário que se desenvolveu nos cinco anos que se seguiram proporcionou um manejo realístico e forte do PRSV nas plantações com pouca chance da doença ser evitada completamente. A situação foi previamente descrita em 1998 e é transcrita aqui uma vez que ela proporcionou o sentimento de urgência que a indústria de mamão do Havaí enfrentou no período de 1992 a 1997, como pode ser evidenciado em fotos tiradas na área durante o mesmo período (Figura 5).

Figura 5
Transcrito da Annual Review of Phytopathology:
A inevitável entrada do PRSV no distrito de Puna na ilha do Havaí foi descoberta durante a primeira semana de maio em campos de mamoeiro em Pahoa, 1-3 milhas da maior área plantada com mamoeiro em Puna (23). Aparentemente a infeção tinha se estabelecido na área há vários meses, de acordo com os sintomas nos frutos e o fato de muitas plantas estarem infetadas numa única área. Inspeções imediatas da área revelaram o PRSV em pomares abandonados, bem como em pomares jovens que ainda não estavam produzindo frutos. O PRSV estava pronto para invadir as principais áreas produtoras de mamão de Puna, as quais incluíam Kapoho, Opihikau, Kahuawai e Kalapana.
O Departamento de Agricultura do Havaí (HDOA) lançou imediatamente um programa de erradicação. A área foi inspecionada e as plantas infetadas foram erradicadas. Houve uma sugestão de destruir todas as plantas da área, no entanto, a ideia não foi aprovada pelos produtores. Contudo, o programa do HDOA para marcar as plantas a serem erradicadas pelos produtores foi iniciado em 1992 (23). Em setembro de 1992, 4.915 plantas tinham sido erradicadas em Pahoa, e o número de plantas a serem cortadas por semana decresceu para menos de 85, proporcionando esperança de que o vírus havia sido contido (23). Contudo, a esperança da contenção do vírus teve vida curta. A incidência de PRSV aumentou dramaticamente em Kapoho, que era próximo de Pahoa, uma vez que o programa voluntário de erradicação de plantas não foi estritamente seguido e os produtores com elevados índices de incidência abandonaram seus campos de produção, criando assim grandes reservatórios de inóculo para os afídeos adquirirem e disseminarem o vírus (24). No final de 1994, aproximadamente todos os mamoeiros de Kapoho foram infetados pelo vírus. Em outubro de 1994, o HDOA declarou que o PRSV era incontrolável e parou com a prática de marcar plantas para serem erradicadas. Em menos de três anos, a terça parte dos mamoeiros de Puna estava infetada.... ... Cinco anos depois da chegada do vírus em Pahoa, a área inteira de Puna estava severamente afetada.
As pesquisas para o desenvolvimento de mamoeiro GM com resistência a PRS começaram em 1985. Foi empregado o conceito de resistência derivada do patógeno ou resistência derivada do parasita. Este conceito basicamente estabelece que plantas que contem gene(s) ou seqüência(s) do patógeno são protegidas contra efeitos deletérios do mesmo ou de patógenos estreitamente relacionados. Para o mamoeiro, nossa estratégia foi desenvolver mamoeiro transgênico com o gene da capa proteica (CP) do PRSV que poderia proteger as plantas transgênicas contra danos causados pelo PRSV. Sumariamente, a pesquisa para a obtenção de mamoeiro transgênico envolveu isolamento e seqüenciamento do gene CP do PRSV do Havaí; transformação de calo embriogênico de mamoeiro Sunset não transgênico, um mamoeiro comercial do Havaí; seleção e regeneração de plantas transformadas com o gene CP do PRSV; seleção de plantas transformadas para resistência ao PRSV; experimentos de campo; regulamentação e comercialização.
IEm 1991, foi desenvolvida uma linhagem de mamoeiro GM resistente a PRS, a qual foi designada de 55-1 (Figura 6) e subseqüentemente testada em campo para resistência (Figura 7). A linhagem de mamoeiro 55-1 foi usada para criar os cultivares SunUp e Rainbow. SunUp é uma versão transgênica de seu progenitor de polpa-vermelha, cultivar Sunset e é homozigoto para o gene CP. Rainbow é um híbrido F1 criado através do cruzamento do SunUp transgênico com Kapoho não transgênico. Kapoho era o cultivar dominante em Puna quando o PRSV foi descoberto lá em 1992. Os cultivares transgênicos foram testados no campo, regulamentados pelo governo dos Estados Unidos, e subseqüentemente comercializados através da liberação de sementes de SunUp e Rainbow para os produtores em 1998.

Figura 6 |

Figura 7 |
O mamoeiro transgênico, especialmente o Rainbow, permitiu os produtores de mamão recuperar Puna da destruição por PRS (Figura 8).O uso da engenharia genética permitiu a introdução de propriedades de resistência diferentes, não disponíveis nos germoplasmas existentes, diretamente em cultivares comerciais disponíveis sem alterar outras propriedades. As propriedades introduzidas por engenharia genética poderiam ser geneticamente transferidas por sementes, de forma estável. Isso possibilitou o rápido desenvolvimento de cultivares que salvaram a indústria de mamão do Havaí e que atualmente representa 70% da área plantada com mamoeiro. A estabilidade genética da linhagem transgênica 55-1 permitiu o desenvolvimento de uma nova posição do mercado de cultivares de mamoeiro com as mesmas propriedades de resistência.

Figura 8
Cucurbitáceas. O PRSV juntamente com outros potyvirus, incluindo o Zucchini yellow mosaic virus (ZYMV) e o WMV são fatores limitantes para a produção de cucurbitáceas no mundo inteiro. Os afídeos de fato colonizam as cucurbitáceas muito mais do que o mamoeiro, e o controle do vetor para o manejo de PRSV-W em cucurbitáceas não tem sido satisfatório para PRSV nem para a maioria dos potyvirus que infetam as cucurbitáceas. Algum sucesso tem sido demonstrado no nordeste dos Estados Unidos, particularmente com abóbora de verão e meloeiro, através do uso de cobertura das culturas na primavera para prevenir a primeira entrada de afídeos virulíferos. "Mulches" refletivos que repelem os afídeos através da luz UV refletida são também adequados, mas de forma mais apropriada em áreas desérticas com sol regular. Contudo, práticas culturais usadas para o manejo de doenças ocasionadas por vírus não são adequadas para o controle satisfatório de PRSV em plantios comerciais de cucurbitáceas.
Diferentemente do mamoeiro, a resistência genética ao PRSV tem sido identificada em espécies de cucurbitáceas e estas resistências têm sido incorporadas com sucesso em cultivares comerciais de cucurbitáceas através de vários programas de melhoramento. A lista de cultivares comerciais resistentes/tolerantes a PRSV-W pode ser encontrada em: Vegetable MD Online.
A incorporação de resistência/tolerância em cucurbitáceas por cruzamento genético tem sido largamente usada com sucesso para produção de cultivares populares de cucurbitáceas. O plantio de cultivares resistentes ou tolerantes a vírus reduz grandemente a pressão do vírus e a subseqüente chance do desenvolvimento de uma epidemia de vírus até mesmo para outra cultura que esteja sendo cultivada nas proximidades.
A resistência a PRSV-W é controlada por um único gene dominante em pepino (Cucumis sativus) e um único gene dominante em meloeiro. Em abóbora (Cucurbita spp.), a resistência a PRSV-W é controlada por um único gene recessivo identificado em Cucurbita moschata e por três genes parcialmente dominantes em C. maxima. Fontes de resistência ao PRSV-W também foram registradas em melancia. Uma extensiva seleção para resistência a PRSV-W numa coleção de germoplasma de melancia no USDA (total de 1.650 acessos) identificou um único lócus recessivo (prv) em planta de Citrullus lanatus var. citroides acessos (PI) introduzidos da África do Sul (PI 244017, PI 244018, PI 244019), Zimbabwe (PI 482342, PI 482318, PI 482379) e Botswana (PI 485583). Resistência foi também identificada em C. lanatus var. lanatus acesso da Nigéria (PI 595203). Todos os dados sobre resistência a vírus em acessos PI foram submetidos a The Germplasm Resources Information Network (GRIN)para futuro uso por pesquisadores.
Como as cucurbitáceas são freqüentemente infetadas simultaneamente por outros potyvirus, a resistência somente ao PRSV-W é insuficiente para produção comercial. O desenvolvimento de novos cultivares com resistência múltipla a vírus pelo cruzamento convencional pode ser difícil, caro e demorado, uma vez que além dos genes de resistência, propriedades agronômicas desejadas devem ser também incluídas no processo de seleção.
A engenharia genética através do uso da estratégia de resistência derivada do patógeno é um dos métodos mais apropriados e eficientes para o desenvolvimento de variedades resistentes a vários vírus. De fato, várias variedades de abóbora com resistência múltipla aos vírus que comumente infetam cucurbitáceas têm sido desenvolvidas por técnicas de engenharia genética (EG). Na existência de resistência natural, a combinação do cruzamento convencional com estratégias de EG pode ser útil e eficiente para o desenvolvimento de novos cultivares com largo espectro de resistência. Um bom exemplo é o cultivar de abóbora verde de pescoço longo Conqueror III desenvolvido por Seminis. Conqueror III possui resistência transgênica aos potyvirus, ZYMV e WMV, ao cucumovirus, Cucumber mosaic virus (CMV) bem como tolerância natural ao PRSV-W obtida por cruzamento convencional.
Significância
A PRS é uma das mais destrutivas doenças do mamoeiro e ocorre em todas as regiões onde o mamoeiro é cultivado. Ela tem sido referida como o principal fator limitante para a produção comercial do mamoeiro particularmente no Havaí, áreas da Tailândia, Taiwan, Índia, México, Brasil, Bangladesh, Filipinas e na região sul da China. Adicionalmente, o PRSV-W é também a causa de sérias perdas em todo o mundo em várias culturas de cucurbitáceas de regiões tropicais, subtropicais e temperadas.
A PRS possui histórica, econômica, científica e cultural significância para a indústria de mamão do Havaí por mais de 70 anos desde o tempo que foi primeiramente descoberta nos anos de 1940s na ilha de Oahu. Inicialmente ela causou sintomas relativamente fracos até a metade dos anos de 1950s quando uma nova estirpe severa de PRSV inicialmente descrita como Papaya mosaic virus emergiu a partir da estirpe fraca original ou como uma nova introdução. Dentro de apenas 10 anos de sua ocorrência, a nova estirpe de mosaico amarelo do PRSV tornou-se largamente dispersa e foi capaz de seriamente impactar a indústria do mamão como previamente descrito.
O desenvolvimento dos cultivares transgênicos resistentes a PRS, Rainbow e SunUp e a concomitante liberação comercial dos mesmos no Havaí em 1998, durante a época da crise da doença, desempenhou importante papel para salvar e revigorar a indústria do mamão no Havaí. Atualmente, o mamoeiro transgênico é predominantemente cultivado no Havaí e como em 2010 corresponde a mais de 70% da área plantada com mamoeiro no Havaí. Rainbow e SunUp têm sido comercialmente cultivados e consumidos no Havaí e no resto dos Estados Unidos por mais de uma década sem nenhuma referência sobre efeitos adversos para a saúde humana.
O mamoeiro transgênico do Havaí foi também regulamentado no Canadá e logo se espera seja aprovado no Japão. O acúmulo de dados sobre a segurança alimentar transformou o mamoeiro GM (linhagem 55-1) uma das mais bem caracterizadas plantas transgênicas, proporcionando significativas contribuições para a ciência e o conhecimento nesta área. A aprovação do mamoeiro transgênico no Japão não apenas trará grande impacto para a indústria do mamão do Havaí, mas também constituirá um avanço para a situação dos produtos transgênicos fora dos Estados Unidos, uma vez que este será o primeiro fruto fresco transgênico comercializado no Japão. Se aprovado, os consumidores do Japão terão a oportunidade de uma comparação direta entre produtos GM e não GM. A comercialização de mamão GM no Japão irá nos orientar num cenário real sobre os fatores que influenciam a aceitação de produtos frescos GM pelos consumidores de fora dos Estados Unidos.
Referências Selecionadas
Gonsalves, D., and M. Ishii. 1980. Purification and Serology of Papaya Ringspot Virus. Phytopathology 70:1028-1032
Gonsalves, D. 1998. Control of papaya ringspot virus in papaya: A case study. Annual Review of Phytopathology 36:415-437.
Gonsalves, D., C. Gonsalves, S. Ferreira, K. Pitz, M. Fitch, R. Manshardt, and J. Slightom. 2004. Transgenic virus resistant papaya: From hope to reality for controlling papaya ringspot virus in Hawaii. APSnet feature story for July, 2004.
Gonsalves, C., D. R. Lee, and D. Gonsalves. 2004. Transgenic virus-resistant papaya: The Hawaiian 'Rainbow' was rapidly adopted by farmers and is of major importance in Hawaii today. APSnet feature story for August-September 2004.
Gonsalves, D., J. Y. Suzuki, S. Tripathi, and S.A. Ferreira. 2007. Papaya ringspot virus (Potyviridae). In: B.W.J. Mahy and M.H.V. van Regenmortel (Eds.), Encyclopedia of Virology, 5 vols. Elsevier Ltd, Oxford, UK.
Purcifull, D., J. Edwardson, E. Hiebert, and D. Gonsalves. 1984. Papaya ringspot virus. CMI/AAB Descriptions of Plant Viruses. No. 292. (No. 84 Revised, July 1984). 8 pp. CAB International, Wallingford, UK
Tripathi, S., J. Y. Suzuki, S.A. Ferreira, and D. Gonsalves. 2008. Papaya ringspot virus-P: characteristics, pathogenicity, sequence variability and control. Molecular Plant Pathology 9:269-280.
Yeh, S. D., F. J. Jan, C. H. Chiang, P. J. Doong, M. C. Chen, P. H. Chung, and H.J. Bau. 1992. Complete nucleotide sequence and genetic organization of papaya ringspot virus RNA. Journal of General Virology 73:2531-2541.