Mancha salpicada da folha (Septoriose do trigo, pt)
Mycosphaerella graminicola
Trigo comum (Triticum aestivum L.), Trigo duro (T. turgidum [L.] ssp. durum)

Mancha salpicada em folha de trigo
A mancha salpicada da folha (septoriose do trigo, pt), causada pelo fungo ascomiceto Mycosphaerella graminicola (forma assexuada – Septoria tritici), é uma das mais importantes doenças do trigo. Esta é caracterizada por lesões necróticas (Figura 1) nas folhas e no caule, as quais se desenvolvem depois que as células infectadas colapsam. A doença é mais importante em condições de clima frio e úmido.
Atualmente é a doença do trigo mais importante na Europa e está entre as três doenças mais prejudiciais economicamente nos Estados Unidos. Aplicações intensas de fungicidas aumentam os custos mundiais atribuídos à doença.
Sintomas
Os sintomas iniciais da mancha salpicada (septoriose, pt) são pequenas manchas cloróticas nas folhas que aparecem logo após a emergência das plantas no outono e na primavera. As lesões (Figura 2) ao aumentarem de tamanho tornam-se marrom (castanho, pt) claras e desenvolvem corpos de frutificações escuros (Figura 3). As lesões nas folhas adultas são geralmente longas, estreitas e delimitadas pelas nervuras, mas podem ter também formato elíptico ou irregular, principalmente em plântulas ou folhas que foram infectadas quando jovens. As lesões adultas possuem estruturas reprodutivas marrons (castanhas, pt) ou pretas, picnídios (assexuado) ou pseudotécios (sexuado). Os picnídios ou pseudotécios se desenvolvem em cavidades subestomáticas do hospedeiro e estão portanto espaçados regularmente dentro das lesões (Figura 3).

Figura 2 |

Figura 3 |
A mancha salpicada (septoriose, pt) é encontrada nos mesmos campos e nas mesmas plantas infectadas por Phaeosphaeria nodorum (estágio assexuado: Stagonospora nodorum), agente causal da septoriose ou mancha das glumas no trigo. Quando há ocorrência concomitante dos dois patógenos, eles são chamados coletivamente de complexo da mancha de Septoria ou complexo da septoriose

Figura 4 |

Figura 5 |
Biologia do Patógeno
Mycosphaerella graminicola é o nome do estágio sexuado (teleomórfico) do patógeno. O estágio assexuado (anamórfico), Septoria tritici, foi descrito pela primeira vez como sendo o agente causal da mancha salpicada (septoriose, pt) em 1842 por Desmazieres. Mycosphaerella graminicola (Fuckel) J. Schrot foi relacionada com S. tritici na Nova Zelândia por Sanderson em 1972. O fungo é um ascomiceto da classe Dothideomycetes, ordem Capnodiales, família Mycosphaerellaceae (Figura 6). Mycosphaerella é um dos maiores gêneros de fitopatógenos e inclui o patógeno da sigatoka negra da banana, M. fijiensis, e muitos outros patógenos de importantes culturas agrícolas. Uma espécie próxima de M. graminicola é patógeno da mancha foliar em cevada, Septoria passerinii.
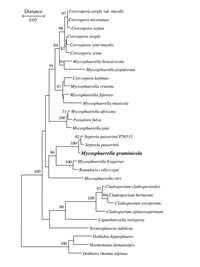
Figura 6
Reprodução Assexual
Esporos assexuais, ou conídios, são hialinos e alongados, e são produzidos em estruturas chamadas picnídios (Figuras 7-9). Cada esporo possui geralmente entre 3-7 septos e mede aproximadamente 2,6 x 62,5 µm. A germinação dos conídios pode ocorrer nas células laterais ou intermediárias. Eles são liberados dos picnídios em cirros (massa espiralada de esporos saindo pelo ostíolo), que geralmente são esbranquiçados a amarelo-claro. Muitos ciclos de multiplicação assexuada podem ocorrer em um ciclo da cultura.
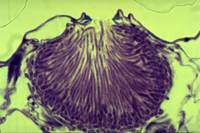
Figura 7 |

Figura 8 |
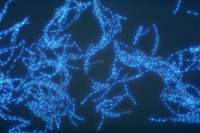
Figura 9 |
Reprodução Sexuada
Corpos de frutificação, chamados de pseudotécios, também são produzidos na lesões. O fungo possui um sistema de acasalamento heterotálico bipolar; indivíduos dos dois grupos de acasalamento, designados de mat1-1 e mat1-2, precisam se encontrar para que a reprodução sexuada ocorra. Os pseudotécios são formados abaixo da epiderme do hospedeiro. Eles são marrom (castanho, pt) escuros e globosos e medem entre 68-114 µm de diâmetro. Ascos, contendo ascósporos, medem aproximadamente 11-14 x 30-40 µm. Os oito ascósporos, encapsulados em cada asco, são hialinos e elípticos, e com cerca de 2,5-4 x 9-16 µm de tamanho, consistindo de duas células de comprimento desigual (Figuras 10-11). Os ascósporos são ejetados dos ascos quando adultos devido a flutuações no nível da umidade relativa seguida por períodos de molhamento.
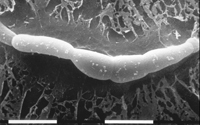
Figura 10 |
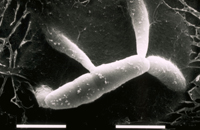
Figura 11 |
Os conídios de M. graminicola podem germinar em água através de uma ou das duas extremidades ou através das células intermediárias. A germinação dos esporos ocorre geralmente 12 horas após o contato com a folha e em condições de umidade elevada. Pelo menos 20 horas de alta umidade relativa são necessárias para que a infecção tenha sucesso. A resistência ou suscetibilidade do trigo não afeta a germinação dos esporos na superfície das folhas.
A penetração nas folhas ocorre primeiramente nos estômatos (Figura 12). As hifas que entram pelos estômatos são constritas a ~1 µm de diâmetro mas alargam após entrarem na cavidade subestomática. Após a colonização da cavidade subestomática, as hifas proliferam extracelularmente no mesófilo (Figuras 13-15), mas não o penetram e também não penetram na epiderme. Os sintomas macroscópicos da doença geralmente não aparecem antes dos nove dias após o contato com o patógeno. As células do mesófilo morrem rapidamente por volta dos 11-18 dias após a infecção e imediatamente antes do aparecimento dos sintomas.
O crescimento de M. graminicola é hemibiotrófico. É representado por um crescimento biotrófico no estágio inicial do processo de infecção, obtendo nutrientes a partir do apoplasto ao redor de células vivas, e posteriormente, mata as células hospedeiras que o circundam e torna-se necrotrófico (utilizando tecido morto) nos estágios finais do processo de infecção (Figura 16). O processo de infecção no trigo por M. graminicola é, portanto caracterizado por dois estágios e pelo menos cinco fases:
Estágio 1 – crescimento biotrófico:
i. crescimento inicial das hifas na superfície da folha. 0-24 horas após contato;
ii. penetração do hospedeiro através de abertura naturais, como os estômatos. 24-48 horas após contato (Figura 12);
iii. fase biotrófica intercelular e hifas se estendem dentro do mesófilo e obtêm nutrientes do apoplasto da planta. 2-12 dias após contato (Figuras 14-15);
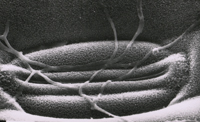
Figura 12 |
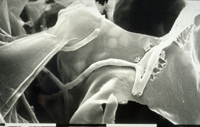
Figura 13 |
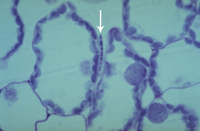
Figura 14 |
Sestágio 2 – crescimento necrotrófico:
iv. mudança rápida para o crescimento necrotrófico associado com o aparecimento de lesões na superfície foliar e colapso do tecido. Aproximadamente 12-14 dias após contato;
v. colonização adicional do mesófilo (Figura 16) e formação de picnídios com conídios na cavidade subestomática do tecido senescente. 14-28 dias após contato:
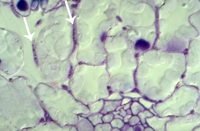
Figura 15 |
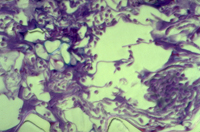
Figura 16 |
Não se conhece o que desencadeia a mudança do crescimento biotrófico para o crescimento necrotrófico. Durante o estágio necrotrófico, as hifas degradam e causam colapso das células do hospedeiro. É cogitado o envolvimento de uma toxina na mudança do crescimento biotrófico para o crescimento necrotrófico, mas isso não tem sido ainda comprovado.
Ciclo da Doença e Epidemiologia
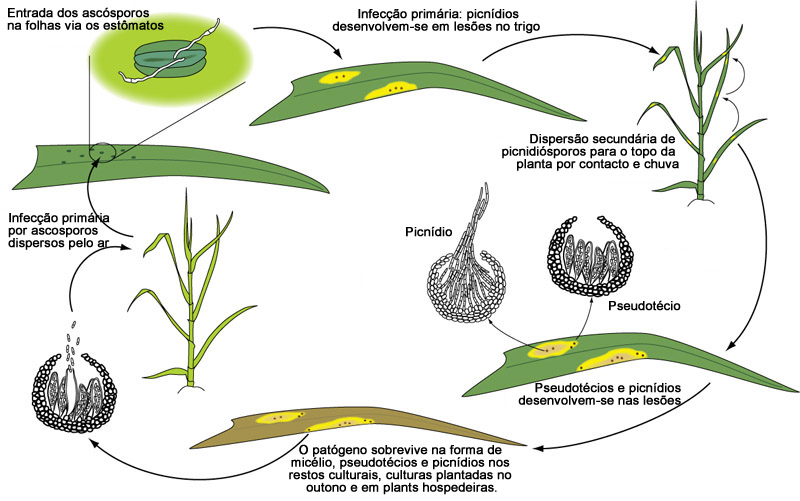 Figura 17
Figura 17Ciclo da Doença
A infecção por M. graminicola é iniciada por ascósporos dispersos pelo ar e por conídios, que foram produzidos em resíduos do ano anterior, dispersos por respingos (salpicos, pt) de chuva (Figura 17). A primeira infecção ocorre logo após a emergência das plântulas no outono (para o trigo de inverno) ou na primavera. Os tubos germinativos do ascósporo são atraídos aos estômatos, pelos quais eles ganham acesso à cavidade subestomática por meio direto ou após a produção de uma estrutura similar ao apressório (almofadas de infecção). Durante muitos dias, as hifas crescem intercelularmente mas com pouco aumento da biomassa.
Após a mudança do crescimento biotrófico para o crescimento necrotrófico, as células colapsam, as lesões são formadas e são identificadas incialmente por pequenas manchas amareladas. As lesões expandem, primeiramente na direção das veias foliares e formando longas e estreitas lesões necróticas. Picnídios se desenvolvem ao redor dos estômatos dentro das áreas necróticas das lesões e liberam conídios em gelatinosos e higroscópicos cirros. Esses esporos são disseminados por respingos de chuva para as folhas da mesma planta ou para as plantas vizinhas. O patógeno sobrevive como pseudotécios nos períodos de ausência do hospedeiro e também como picnídios nos restos culturais. Plantas hospedeiras cultivadas no outono e plantas voluntárias (tigueras) podem ajudar na sobrevivência do patógeno durante o inverno.
Epidemiologia
O inóculo inicial geralmente consiste de ascósporos dispersos pelo ar, os quais causam as infecções primárias nas folhas das plântulas, mas que também podem ser ocasionadas pelos conídios. Infecções primárias, a partir de uma chuva de ascósporos, irão ocorrer uniformemente sobre a plantação e darão origem a lesões que produzirão picnídios, estruturas assexuadas que permitirão a dispersão rápida do inóculo secundário, que são os conídios.
Ciclos secundários da mancha salpicada (septoriose, pt) se dá pelos conídios, que são formados rapidamente com umidade relativa alta, especialmente se há presença de água livre na superfície das folhas, mas pode ocorrer também pelos ascósporos. Picnídios contendo conídios são formados entre 14 a 40 dias após a infecção, dependendo do hospedeiro e das condições da estação de cultivo. Esses esporos são dispersos através de respingos e gotas de chuva, causando dispersão local da doença para folhas não infectadas da mesma planta ou plantas vizinhas. Produção e dispersão de conídios ocorrem rapidamente se comparado com pseudotécios contendo ascósporos, os quais demoram semanas até estarem maturos. Assim, conídios e ascósporos contribuem para a epidemia, mas o ciclo assexual parece dominar durante a estação de cultivo (isto não ocorre no Brasil, onde predomina a fase assexuada). Ascósporos podem ser dispersos pelo ar para longas distâncias, enquanto conídios são improvavelmente dispersos para longas distâncias do local de origem através de respingos de chuva. Conídios ajudam a dispersar a doença verticalmente, em direção ao topo das plantas. Infecção das folhas bandeiras (última folha a emergir no caule do trigo) é comum e leva a uma elevada redução na produção e baixa qualidade dos grãos colhidos. Dispersão de conídios por respingos de chuva pode levar a focos da doença, que podem dar uma aparência desuniforme a sua distribuição na lavoura. Uma aparência mais uniforme da doença é típica de uma dispersão de ascósporos pelo ar no período inicial de infecção.
Muitos ciclos de reprodução sexuada e assexuada durante a estação de cultivo permitem que as epidemias se desenvolvam rapidamente. Restos culturais de folhas e caules altamente infectados permanecem nas lavouras após a colheita e produzirão inóculo para a próxima estação de cultivo.
Manejo da Doença (Meios de Luta, pt)
Cultivares Resistentes
O plantio de cultivares resistentes é a estratégia de manejo (luta, pt) mais simples e econômica para a mancha salpicada das folhas (septoriose, pt). Resistência a M. graminicola pode ser qualitativa (Figura 18) ou quantitativa e é mais comum entre cultivares de trigo de inverno do que os de primavera. Até agora, 13 genes de resistência maior (qualitativos) a mancha salpicada (septoriose, pt) foram nomeados, mapeados e publicados, e alguns deles foram observados com interação gene-a-gene com o patógeno. Muitos outros genes têm sido identificados mas ainda não foram publicados em revistas científicas. Alguns genes têm demonstrado uma resistência duradoura no campo, enquanto outros genes têm falhado devido às rápidas alterações genéticas na população do patógeno. Por exemplo, Stb1 tem sido efetivo em Indiana por mais de 25 anos, enquanto Stb4 foi efetivo na Califórnia por 14 anos até que falhou e durou somente um ou dois anos em Oregon. Cultivares de trigo que são geralmente relatados como resistentes em uma região têm demonstrado suscetibilidade em outra. Isso pode ser conectado à composição genética da população local do patógeno, que pode ser afetada pelos cultivares usados, pelas condições ambientais favoráveis para a infecção e pela importância relativa do estágio sexual no ciclo da doença.
Resistência quantitativa também é conhecida e pode ocorrer comumente em cultivares de trigo. Entretanto, ao contrário da resistência quantitativa contra muitos outros patógenos, aquela contra M. graminicola pode ser dependente do isolado e poderá ser superada mais facilmente. Sempre que possível, o uso dos genes de resistência qualitativa Stb deverá ser combinado com genes de resistência quantitativa para ajudar a manter a sua estabilidade. Marcadores moleculares têm sido ligados a vários dos genes Stb, que através da seleção assistida por marcadores irá facilitar a criação de combinações de genes mais efetivas em novos cultivares.
 Figura 18
Figura 18Controle Cultural
O manejo (luta, pt) cultural pode reduzir a incidência e a severidade da mancha salpicada (septoriose, pt). Rotação com plantas não hospedeiras e incorporação dos restos culturais, alcançado por aração profunda pode diminuir a quantidade de inóculo disponível para iniciar um novo ciclo da doença. Isso pode ser menos eficaz em campo devido à dispersão a longa distância dos ascósporos, mas talvez possa ajudar se a medida for bem coordenada dentro de uma região. O plantio tardio do trigo de inverno (exemplo, metade de outubro versus final de setembro) pode também ser usado como estratégia para moderar a quantidade inicial de infecção por evitar o transporte aéreo de ascósporos para um novo plantio da cultura do trigo.
Controle Químico
Muitos fungicidas são atualmente usados para controlar a mancha salpicada (septoriose, pt) no trigo. O tratamento de sementes com fungicida, como o triticonazole, pode ser usado em regiões aonde o estágio de plântulas pode ser afetado pelo patógeno. Pulverizações foliares, entretanto, são os meios de tratamento mais usados com fungicida. Fungicidas devem ser somente recomendados quando são economicamente viáveis. Os fatores que devem ser considerados incluem o rendimento projetado e as perdas pela mancha salpicada (septoriose, pt) e também se o custo do fungicida justificar o benefício esperado. A suscetibilidade do cultivar de trigo e, em particular, a quantidade da doença afetam a decisão. O monitoramento da doença é crucial para avaliar o seu progresso no campo. O planejamento das pulverizações para períodos em que o patógeno mais provavelmente estiver ativo trará o maior retorno econômico.
O maior problema para o controle químico é que muitas populações de M. graminicola evoluíram rapidamente para a resistência a fungicidas, especialmente para a classe química das estrobilurinas. A primeira resistência de M. graminicola a esses compostos foi detectada em 2002, e populações do fungo, em muitas regiões, são quase todas resistentes. Análise da variação da sequência de DNA dentro de populações tem mostrado que a resistência a estrobilurina foi independentemente adquirida através de pelo menos quatro mutações do gene mitocondrial citocromo b. Por isso, estrobilurinas estão somente sendo usadas em áreas aonde a resistência não se desenvolveu (abundantemente) mas esses compostos ainda contribuem para uma maior vida útil das folhas bandeiras e portanto, rendimento. Entretanto, os fungicidas mais comuns e atualmente usados são os triazóis. A eficácia desses compostos está também diminuindo devido a mutações no gen cyp51, embora outros fatores também possam estar envolvidos. Alternando o uso de fungicidas com diferentes modo de ação ajuda a mitigar o desenvolvimento da resistência.
Controle Biológico
Atualmente, alguns agentes de controle biológico estão sendo avaliados para a mancha salpicada (septoriose, pt), e alguns deles têm se mostrado promissores, mas nenhum deles está ainda disponível comercialmente. Fungos pertencentes a Trichoderma spp. têm sido usados como agente de controle biológico para proteção do trigo contra doenças foliares na Argentina. Uma coleção de Bacillus megaterium, oriunda da rizosfera de trigo e folhas de cevada e de grãos e palha de aveia, foi avaliada para a inibição da doença. O tratamento com a bactéria retardou consistentemente o desenvolvimento da mancha salpicada (septoriose, pt) em até 80% em experimentos de pequena escala. Algumas espécies do gênero Pseudomonas também têm sido testadas como potencial agente de controle biológico. Aplicação de células de dois isolados fluorescentes de Pseudomonas do solo em plântulas de trigo antes da inoculação com M. graminicola reduziu marcantemente o aparecimento dos sintomas. Além disso, o crescimento de Pseudomonas antagonistas não foi afetado por vários fungicidas comerciais.
Importância
 Figura 19
Figura 19A mancha salpicada (septoriose, pt) do trigo ocorre mundialmente e em países diversos como Argentina, Etiópia, Irã, Estados Unidos, Holanda, Rússia, Nova Zelândia e Austrália. A doença no trigo duro é um grande problema no Irã, Tunísia e Marrocos. Epidemias são particularmente devastadoras em países em desenvolvimento, como os do leste da África. Severas epidemias da mancha salpicada (septoriose, pt) podem reduzir o rendimento de trigo de 35 a 50%. Nos Estados Unidos, a mancha salpicada (septoriose, pt) fica atrás somente da ferrugem do trigo em termos de importância, mas é a principal doença do trigo na Rússia e em muitos países do oeste Europeu. O custo dos fungicidas para o controle da doença podem ser altos e o tratamento com fungicidas pode não ser economicamente viável comparado ao preço do grão. Aproximadamente 70% do volume estimado de fungicidas usados em cereais na Europa é usado para o controle da mancha salpicada (septoriose, pt). Na Europa, as estimativas das perdas anuais com a mancha salpicada (septoriose, pt) são de $400 milhões de dólares e as estimativas para os Estados Unidos são de $275 milhões de dólares por ano.
A recente disponibilização do genoma de M. graminicola é um passo importante para o entendimento e identificação de genes e processos que poderão ser usados para ajudar no controle desse importante patógeno. A geração de novos dados genômicos irá contribuir para elucidar as bases genéticas e bioquímicas da interação patógeno-hospedeiro. A informação genômica pode ajudar no desenvolvimento de ferramentas de diagnose molecular para a elucidação da interação entre M. graminicola e trigo, bem como comparações de genomas (genômica comparativa), mapeamento genético e dados de expressão gênica, que irão ajudar grandemente no delineamento de melhores estratégias de controle desta doença.
Referências Selecionadas
Agrios, G.N. 2005. Plant Pathology, 5th edition. Academic Press, Inc, San Diego. 922 pp.
Bockus, W.W., R.L. Bowden, R.M. Hunger, W.L. Morrill, T.D. Murray, and R.W. Smiley. 2010. Compendium of Wheat Diseases and Pests: Third Edition. American Phytopathological Society, St. Paul, MN
Goodwin, S.B. 2007. Back to basics and beyond: increasing the level of resistance to Septoria tritici blotch in wheat. Australasian Plant Pathology 36: 532–538.
Goodwin, S.B., C. Waalwijk, and G.H.J. Kema. 2004. Genetics and Genomics of Mycosphaerella graminicola: a model for the Dothideales. Pages 315-330 in: Applied Mycology and Biotechnology. Volume 4, Fungal Genomics. Elsevier Press, San Diego.
Eyal, Z., A.L. Scharen, J.M. Prescott and M. van Ginkel. 1987. The Septoria diseases of wheat: Concepts and methods of disease management. CIMMYT. Mexico, D.F.
Kema, G.H.J., D.Z. Yu, H.J. Rijkenberg, M.W. Shaw and R.P. Baayen. 1996. Histology of the pathogenesis of Mycosphaerella graminicola in wheat. Phytopathology 86: 777-786.
Kema, G.H.J., J.G. Annone, R. Sayoud, C.H. Silfhout, M. van Ginkel, and J. de Bree. 1996. Genetic variation for virulence and resistance in the wheat-Mycosphaerella graminicola pathosystem I. Interactions between pathogen isolates and host cultivars. Phytopathology 86: 200-212.
Kema, G.H.J., R. Sayoud, J.G. Annone, C.H. Silfhout. 1996. Genetic variation for virulence and resistance in the wheat-Mycospharella graminicola pathosystem II. Analysis of interactions between pathogen and host cultivars. Phytopathology 86: 213-224.
Joint Genome Institute, United States Department of Energy and University of California.Mycosphaerella graminicolav2.0 – Home http://genome.jgi-psf.org/Mycgr3/Mycgr3.home.html
Scharen, A.L. 1999. Biology of Septoria/Stagonospora pathogens: an overview. Pages 19-22 in van Ginkel, M., A. McNab, and J. Krupinsky, eds, 1999. Septoria and Stagonospora Diseases of Cereals: A Compilation of Global Research. Proceedings of the Fifth International Septoria Workshop, September 1999, CIMMYT, Mexico.
van Ginkel, M., A. McNab, and J. Krupinsky, eds, 1999. Septoria and Stagonospora Diseases of Cereals: A Compilation of Global Research. Proceedings of the Fifth International Septoria Workshop, September 1999, CIMMYT, Mexico.